为了挽救一位垂死病人的生命,本文作者和他的同事一道,研究出目前通用的手术步骤,为那些易患心动过速症的病人矫正这种致命的心搏过快。
1978年,费城某银行的一位副行长在工作时突然虚脱,同时他的心跳快得十分危险。幸运的是,他的同事们立即使他的心肺恢复正常,让他保持清醒,直到急救人员赶到现场。他很快被送到宾夕法尼亚大学附属医院,当时我还是该医院一位资历较浅的外科医生。我们两人都没有意识到,在该事件后的几个星期内,我们参与了书写外科手术上的一小段历史。为了竭尽全力地把这位银行家从死亡线上拉回来,我和同事们设计出一种新的手术治疗方案,以矫正引起心脏机能失常的根本性失常。从那以后,几百位病人接受了这种治疗。同时,人们开始进一步研究为什么我们这套出自实践需要的应急方案会如此有用。
我仍清楚地记得这位银行家入院时的体检结果,因为我们实在是太吃惊了,当这位病人初入院时,我们怀疑他患有心脏病(即心肌梗塞):在动脉向心肌组织送血的功能阻滞后,心肌坏死了。但检査结果却是另外一回事。实际上,除去一小块区域在几年前的一次心脏病发作中受损外,大部分肌肉的情况良好。
银行家这次的心脏机能失调,是因为心脏的生物电忽然变得异常危险地不稳定。调节心搏的电路网引起心肌的收缩,从而推动血液在动脉中循环,每分钟大约有72次。他的肌肉接受了频繁得多的信号,使脉动异乎寻常地加快。如果心跳过快,心脏的内室就没有足够的时间去充满血液。因为心脏不能输出它没有吸收的东西,所以在这种情况下向身体各组织(包括心肌本身在内)输送的血液会突然减少,使心脏停止跳动。
尽管起初我们希望找到这位银行家的心脏病又一次发作的证据,但同时我们也明白他的生物电混乱并不是什么罕见的现象。六年前,荷兰林伯格大学的Hein J. J. Wellens观察到某些病人的心脏在发病后几个月或几年会出现心动过速现象。
我们同样明白,用来防止心律不齐(即心搏异常)的药物,能够恢复一些人原有的心脏功能,因此我们尝试了手上的各类药物,但均吿失败。呆在医院的三周时间里,大难不死的银行家又出现三次心脏停跳。在这种情况下要让他出院确实将有生命危险,他本人也知道这一点。
那时,我有幸与专门研究心电异常诊断的Mark E. Josephson和Leonard N. Horowitz —起工作。他们认为,银行家的麻烦出自心脏中闭合电路干扰。结果情况的确如此,我们想,也许用外科手术就能够中断该回路。
为了理解我们的推理,了解一点心脏电路是如何控制心脏活动的知识会有所帮助。心脏分为四个室,本质上是以传导组织为内衬的一团肌肉(即心肌):传导组织就是形成一种内部神经系统的特殊纤维。这些特殊纤维将电搏动迅速传到整个心肌层。
在电搏动的刺激下,心肌产生收缩——这种收缩首先是在心脏上部,接着又传到心脏下部。随着心肌的收缩,氧气已耗尽的静脉血被排挤出右心房(心脏上部两个小室之一)而进入右心房下面大一些的右心室。然后,右心室使血液加入肺循环,在补充氧气后,血液被输入左心室。在心脏右边的这些活动进行的同时心肌层从左心房抽取补充了氧气的血,输入左心室,然后从这儿输入主动脉,主动脉则将血液送往身体各部分。
诱发这些功能的信号发源于一组被合称为窦房结的传导组织细胞。这种结位于右心房的上端,它确定了心搏的速度,因此,它常常被称作心脏的起搏器。由它来确定速度,仅仅是因为它发出的搏动比起心脏其他区域来要频繁,达到了大约830毫秒一次。如果某种东西能诱发心脏的其他某处以更快的速度搏动,就如银行家的心脏中出现的情况那样,这种东西就会成为新的起搏器。尽管窦房结能够对来自心脏以外的信号起反应,但它通常都是自发地激活的。换句话说,它处于一种“自控状态”,具有一种被称为自动性的能力。
这种自动性来源于包围着结细胞的膜上独特的泄漏。如同肌肉细胞和神经细胞周围的膜一样,结细胞膜上也散布着输送离子出入细胞的泵。这种交换的净结果是产生了穿过膜的电势,即膜两侧的电荷分布不等。不过,肌肉和神经细胞能维持其静止的电势直至被外部刺激所扰动,而结细胞与这两种细胞不同,它能使某些离子漏出细胞。这种外流使膜电势降低至临界值。
在临界值上,膜又使大量的其他离子流回细胞里。这种冲击能暂时使细胞去极化(即消除膜电势),并实际上使膜的极性颠倒过来。这种去极化作用构成一次搏动。在搏动产生后,细胞重新极化,并为下一次搏动作准备。
起源于窦房结的一细胞内的搏动一般会立即快速通过结的其余部分。搏动从结开始,在160到200毫秒的时间内穿过整个心脏。它们沿着传导纤维传递,首先穿过左右两个心房,然后在房室结处重新聚集,这个结是其中心正好位于心室上的细胞束。在短暂的停顿后,它们沿着分为两支的传导束向下运行至心室;传导束更进一步分叉,形成更加细小的凸状分叉,即Purkinje氏纤维。一支分叉的传导束为一个心室服务,发射的信号首先沿着中隔(把两个心室分开的壁)表面传到心尖,又从心尖沿着外(侧)壁内表面传至心室顶部
搏动通过传导纤维到达肌肉时,它们就激活了其下的细胞 。肌肉细胞也能传送搏动,尽管比起传导纤维来,它们的速度要慢一些。心内膜(心壁的内表面)的细胞首先被去极化,然后传递心搏沿着肌肉的厚度方向到达心外膜。 去极化作用接着又导致肌肉收缩。
Josephson和Horowitz认为,受损的细胞打乱了银行家心脏内电的正常流动。在心脏病发作以后,由此而成的疤痕(因血液输送不足而死亡的一组细胞)周围的许多细胞继续存活,但其电活性变得异常;它们会异常缓慢地传送搏动,或是在本该平静的时候兴奋起来。
我的同事们指出,这些受损区也许会通过在肌肉中形成闭合回路来扰乱信号发送的稳定性。 闭合回路是一种导电路径,通过它搏动可以循环往复而不会消失。在我们的病人的病况中,回路看来是位于左心室中;与大多数其他病人一样,银行家的心脏病也发生在此处。(现在人们相信,心脏病发作后某个时间闭合回路被激活的病例大量存在,在美国每年约1200万心脏病患者中约占10%。)
人们可以设想一下比如心搏波遇到左心室内椭圆疤痕的底部时搏动通过闭合回路的情况。心搏波到达疤痕处时,会分为两路,分别绕过死区的两侧。如果受损细胞以某种方式打断了沿两路中任何一路传送的搏动,搏动也许仍会沿相对的一路上传,并绕过椭圆物的顶端。然后,它们会穿过先前受阻的路径,并重新回到回路的起——我们把该区域称为起端。
如果通过回路的时间足够长,起端就会被重新极化,并会再次对剌激产生反应。(在细胞去极化和重新极化之间的这段时间内,细胞一般都是麻木的,即不能对新的搏动产生反应。)在这种情况下,搏动能够重新刺激回路的起端,把搏动传回受损的回路,也传到心室肌肉的其余部份。尽管传导缓慢,搏动通过整个回路的时间比起正常心跳间的间隔来还是要快一些。因此,持续不断的循环能使回路起端成为新的起搏器,从而促成了心室内持久的心动过速:心室的泵动过快。
我们知道,经过闭合回路的连续通路会出现在人类身上,因为Wellens于70年代就证实了这一事实。对我们而言,值得庆幸的是,他还介绍了确定曾从威胁生命的心动过速症中幸存下来的病人身上是否潜藏着被遏制的回路以及现有的药物是否能阻止这种路径的重新激活的方法。医生把叫做定速导管的电极插入病人的心脏中,并发出一系列经过专门定时的搏动。 如果现持续不断的早搏现象,就证实病人身上有一闭合回路。(相形之下,输入健康心脏的搏动只会产生不会重复的单次收缩。)下一步就是让病人使用抗心律不齐的药物,如果用药后,节奏均匀的刺激不能诱发出持续不断的心动过速,就说明此种药物是有效的。
当Josephson和Horowitz在银行家身上实施Wellens介绍的方法时,他们发现他们确实能够诱发出持续不断的心动过速,并且糟糕的是,没有任何抗心律不齐的药物可以帮助这位病人。此后不久,我在他们两位那间小得可怜的没有窗户的导管插入实验室中见到他们。得知我们的病人心脏内有一威胁生命的电通路后,我们开始想知道我们是否可以通过用外科手术的方法除全部或部分起坏作用的回路(尤其是起端部分)从而阻止该回路被激活。我们意识到这个计划可能遭致失败,或者说切除了这一组织,事实上仍会产生其他问题。但是我们已别无选择。
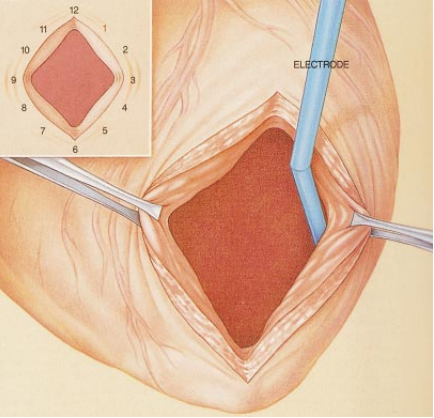
在手术前,我们不得不找到一种方法以确定这一起破坏作用的起搏器的位置。我们希望能通过分析到达直接放置在心脏内表面或外表面的电极(见图4)的信号来达到我们的目的 。更明确地说,我们计划用定速电极来诱发持续不断的心动过速。在每一次心跳过程中,我们将对沿着心脏病发作的疤痕的受损边缘上的一地点(由一小群细胞组成)的电流进行测量。我们将从一任意选定为12点钟的位置开始,直至围绕“钟面”重新回到起点处。
我们可以通过把每一区域中电激发的时间与健康心脏中观察到的时间加以比较来画出该回路的轮廊。比健康组织先产生电流的区域可以知道是属于该回路的;最早兴奋的地区就充当了起搏器。为了达到这一目的,我们不能依靠一般的心电图术,因为它缺乏我们所需的特异性。由贴在皮肤上的电极记录出的通常的心电图,可以反映心脏中无数个细胞总的活动;但它们不能精确识别在任何给定时刻去极化的是哪块肌肉。
我们这个总的方法是有意义的,但没有人曾试图应用从心脏表面直接记录的方法来“描绘出”活的心脏中正在起作用的心室内流动的信号。我们不知道自己是否能得到辨认得出的结果。接下去的一天,我被安排从另外一位病人身上取出患了癌的肺。他心很好,同意我们试着从心脏外面直接检测信号。使我们高兴的是,心搏波动穿过肌肉上的任意一点时我们均能清楚地辨别出来。
现在我已准备好与银行家本人讨论我们所提出的策略。因为不知道回路的起端(即先兴奋的区域)更接近心肌的内侧还是外侧,我们打算既画出内表面,也画出外表面。我们计划通过现存的疤痕打开心脏,从而到达内部。(毕竟,切开健康的组织以进入心脏将会不必要地破坏新的组织。)如果我们找到了患病的部分,我们建议将其用手术切除掉。手术中,为了保持血液仍然在病人体内流动,我们将不得不把病人连在一个心肺器上。这个仪器把不含氧的血转移到人造肺上。然后,含氧血通过主动脉重新被抽吸回来,加入动脉循环。
人们常常把医生称为“无所畏惧的”,但我们的病人才是真正的无畏。在我详细地叙述了我们的治疗方案后,他提出了自己担心的问题:“你以前曾做过几次这样的手术?”我告诉他 :“从来没有。”接着他又问了其他人曾做过几次这种手术。回答说从来没人试过。尽管我的回答使人不安,他却满怀信心地笑笑,说道:“干吧!”
第二天早晨,我们才准确地找出了最早的兴奋区并将其切开,结果这个区域是位于内表面,(如今,我们已知道所有的闭合回路实际上都是曲折地通过心内膜里或心内膜附近的细胞。)我们的病人康复后,不仅重新开始了银行工作,而且还成为县税款评定员。几年前,我失去了他的消息,但在手术后十年内,他没有再产生心律不齐。
不过,并不是每一位接受这种手术的病人都像银行家这么幸运。在所有从持续不断的心动过速中缓过气后就接受了这种手术的病人中,约有9%在手术中或手术后1个月内即死去。另一方面,80%的接受了手术治疗的病人的心动过速症在术后至少有一年时间没有复发,还有60%的管了五年甚至更长时间。心肌损伤越少的病人,手术效果就可能越好。
我们除了收集有关幸存者存活率的统计资料外,还从1978年起,开始发现闭合回路不一定象我们以前想象的那么大。微小的回路同样是致命的。事实上,解剖结构上很细微的闭合回路似乎是各种回路中最常见的一种。
微回路可能存在的看法是由另一位外科医生、杜克大学的James L. Cox最先于70年代早期提出的。他证明了由散布着死细胞岛的受损细胞组成的一小块斑驳的组织,能够建立起形成反复的心动过速所必需的条件。在这种微回路中,在杂色心肌块的入口处遇到路径分叉的搏动也会分叉,并沿着两条路径传递(见图3)。同较大的闭合回路中出现的情况一样,沿着一条路径传递的搏动会遇到单向阻塞。同时,沿着另一条路径流动的心搏则循着受损细胞组成的曲径前进,并沿着先前阻塞的小径返回。
如果通过受损组织的传导足够慢,心搏将在回路的入口(即起端)不再麻木后回到这一部位。起端的兴奋接着会刺激心室肌肉,并使其收缩,同时将心搏反复传回微回路。这样,闭合回路不是沿着疤痕的周围传递,而是沿着一条穿过在心脏病发作的疤痕和完全健康的组织间的受损边缘里的细胞组成的更为集中的曲径循环往复。
我的两位同事Glenn J. R. Whitman和Michael A. Grosso在八十年代初决定检验一下这种见解,他们能在受检动物的心室内生成一些由不同成分(即死细胞和活着的受损细胞)混合组成的小区。这些动物以前不会产生电诱发的自维持心动过速,现在则变得非常容易受其影响。
Whitman和Grosso 假定,如果杂色的组织出了毛病,那么,杀死该组织内的所有细胞则可将心电活动恢复正常。心搏在遇到被杀死的均质组织时,不是迂回通过这一危险的迷宫,而是要么消失,要么绕着它穿过相邻的健康细胞。果然,当杂色的心肌块被破坏后,心律不齐的易感性就消失了。
这些发现说明,斑点为反复的心动过速埋下了伏笔。它们也为解释为什么由我们和其他人对不同病人试验的另一种外科手术疗法的作用并不好提供了事后的认识。由于相信这个疤痕本身以某种方式引起了心电的扰动,我们先前在手术时只取走死的组织。Whitman和Grosso的工作表明,这一方法注定要失败,因为它没有破坏真正的“杀手”—— 混合着死细胞和活细胞的区域。
不过,我们仍然面临两大值得注意的难题,一是理论上的,一是临床上的。为什么易感的病人并不是每次心跳时闭合回路都会被激活?换句话说,为什么人们常常能在致命的心律不齐出现前存活数月甚至数年?我们也想知道,我们如何才能在病人发生可能致命的心动过速之前,就将处于再进入心动过速状态的危险中的病人识别出来。
关于闭合回路为什么不随着每次心跳而迅速激活的过于简单化的解释似乎是:房结发射的搏动不能在有问题的路径中反复循坏。在第一次循环结束时,它们回到仍然麻木的起始区。重新进入回路受阻后,它们无法进一步前进。令人遗憾的是,这种解释不能阐明为什么会出现持续不断的循环。我们现在认为,在运气极糟的病例中,当位于闭合回路附近的某个电激发细胞自发地在窦房结以及房室结的两次受激之间的短暂时间内激发起来时,这种循环也被激发起来。
在考察了我们的同事、宾夕法尼亚大学附属医院的E. Neil Moore和Joseph F. Spear于70年代后期提出的研究成果后,我们得出了上述结论。通过把细胞钉上针状的小电极,Moore和Spear能够追踪从心脏病疤痕附近区域中取出的受损的单个心脏细胞的膜电位的变化。去极化后,健康的细胞会平稳地重新极化。相形之下,受损细胞的膜电位在重新极化期间会明显波动。
我们假定,这些波动有时会导致去极化过早,即一次搏动的激发。如果一个过敏细胞恰好位于闭合回路的旁边,在正常的心跳间隔中,它很有可能将搏动引入这一令人烦恼的路径中。
这种心搏的引入可能激活闭合回路,而从窦房结发出的搏动则不会,因为最近通过路径的一次心搏可以改变这一路径的电化特性,并减慢随之而来的信号的传递速度。因而由过敏细胞传送的搏动比起由窦房结发出的先前一个信号来,其通过回路的速度更慢。如果这个难以捉摸的搏动的传递时间正好合适,在回路中传递的搏动则会在千钧一发的时刻回到它的入口处:在该区域重新兴奋后(从而可以向前传送搏动)且窦房结第二次激发之前(从而获得对心跳的控制)。撞上一个目标受体后,搏动可能会沿着这一致命的回路行进许多圈。

我们的第二个难题——轻松地鉴别出病人正处于重入心动过速状态的危险中——是由我们的同事、多才多艺的Michael B. Simson巧妙地解决的。正如我有时所说的那样,他除了是一位极好的心脏病专家以外,同时也热衷于开跑车和运用计算机。一天晚上,在参加了一次外科手术研究会后,他驾驶着他那辆年久失修的跑车回家。在车上,他开始思考由跑车的发动机罩发出的电噪音,即一组看来似乎是随机的信号。他推想道,如果自己只是简单地监测到达机罩的电流,由此得来的数据将是混乱得无法解释的。不过,如果他想追踪从分电器上发出的电脉冲,他可以通过信号平均法来分辨出来。
在这一过程中,他将记录下在他的跑车的分电器转子转动的特定相位上由机罩流出的电流以及流入的电流的电压和方向(电矢量)。如果他把在一给定相位上反复测量所得的信号总和起来,随机的电流会彼此相抵消,只剩下那些由转子产生的记录。用选定的相位上测得的读数的个数去除这一结果,就会为他提供分电器在那一相位上产生的电流的测量值。
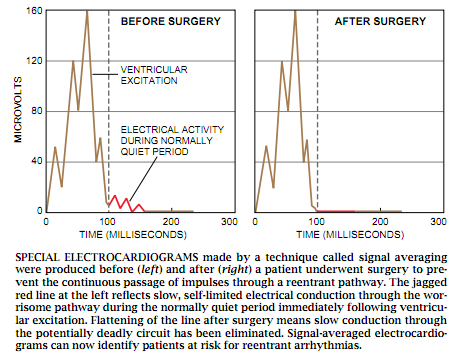
Simson接着想到,他可以将这一方法的主要精髓应用于那些心脏病患者身上,以检查他们对重入心动过速状态的易感性。也许信号平均可使他探测出在信号正常地通过心室后仍继续存在的一种非常缓慢的心电活动。他发现的大多数这类过剩的活动,都反映出通过有潜在危险性的闭合通道传递的姗姗来迟的搏动。换一种方式来说,Simson认为可以像普通的心电图测试那样在皮肤上放置电极,不过却只记录下在心电图上人们熟悉的QRS波形成后40毫秒内产生的电流。(QRS波反映出心搏通过心室的传播情况)心脏细胞在此时一般都是平静的,产生出心电图轨迹上的一段平伸线。信号平均后与这种正常图形产生的偏离,表明了在闭合路径中有缓慢传导存在。

那个晚上,Simson呆在他的地下室里制造一台信号平均设备。第二天,我和Josephson,Horowitz 按计划要对我们的一位病人体内引起重入心律不齐状态的组织进行切除。手术前,Simson把他这一新的记录器安在病人身上,并注意到,正如事先预料的那样,紧接着心室的兴奋之后的一段通常情况下应当平静的时间内,病人的心电活动有一短暂的波动。但这一信号实际上指示的就是闭合回路中后期的心搏传导吗?如果手术后这种波动消失,答案当然是肯定的。手术进行得非常顺利。Josephson和Horowitz认出了闭合回路,我则切开了入口处。手术后,Simson重新将他的仪器安在病人身上。后QRS波动消失了。
1978 年以来,我们走过了一条长长的路。我们认识到为什么我们最初凭推测设计出的手术方案会如此有用。这种方法打断了结构上受损的路径,这条路径在附近细胞的异常激发下产生了心搏通过循环路径的反复流动,此外,我们也具备了通过非侵入性的方法识别出处于危险中的病人的能力。
1984 年我转到科罗拉多大学,在那儿我们使用Simson的检査法进行常规诊治。我们通常在心脏病发作后等待二至三月,以便确诊我们并没有探测出“自动的”心动过速的诱因。病人心脏病发作后一周左右,垂死的细胞常常在本该安静时兴奋。这种行为能导致心脏早搏。如果该细胞反复去极化,这种活动会使心跳加速,有时还引起心力衰竭。自动的心动过速的趋势随着垂死细胞的死亡,一般在几周内即可消失 。
如果在适当的等待时期后发现了循环心动过速的倾向,且药物疗法并不管用,病人可以考虑其他的治疗方案 。我谈到一种以上的选择,是因为外科手术不再是替代药物的唯一选择。从 1980 年开始,一种叫做内植除纤顫器的仪器也能够发挥效力了。如果心跳开始加速,该仪器发出电震,使整个心脏立即去极化,从而为窦房结提供一个机会,使其重新恢复起搏器功能。
死于除纤顫器移植手术中的并发症的病人,大约只有死于外科手术带来的后果的病人一半那么多。不过,与外科手术相比,仪器只是减轻了症状,并不能使其痊愈。接受除纤颤器的患者将继续遭受心动过速的侵袭,并且他们在每次通过电震恢复正常心律时可能失去知觉。所以,他们不能从事开车或其他那些突然眩晕可能导致危险的活动。如果认为对某位特定的病人而言,用手术消除其闭合回路是最佳疗法,目前在许多医学中心均可以进行这种手术。
总的说来,公正地说,从心脏病中活过来的大多数病人都不容易患心律不齐症。一小部分易感的病人中可能有一半能接受药物治疗。不过,对于那些对药物不起反应的病人,除非他们接受其他治疗,否则,他们中有 80%的病人都有可能在第一次心动过速发作后的一年内死于这种心电异常。对于这类病人的大多数,他们知道了只要具备费城银行家那样的勇气即可治愈其实就该放心。
〔郭 敏译 李 文校〕
文中注释:
* 医学博士,丹佛市科罗拉多大学卫生学研究中心外科学系系主任及教授。
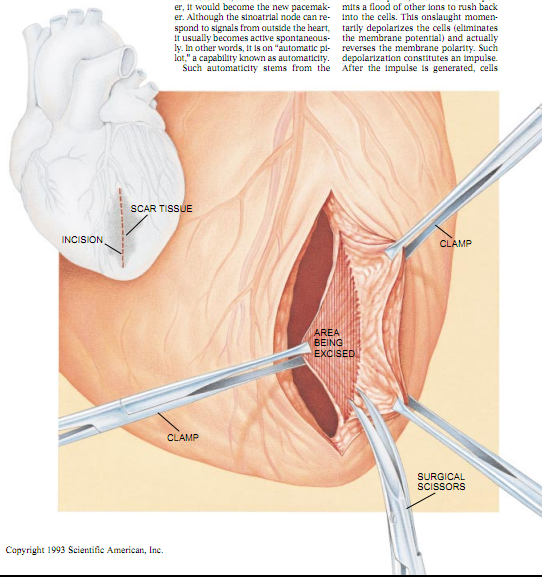
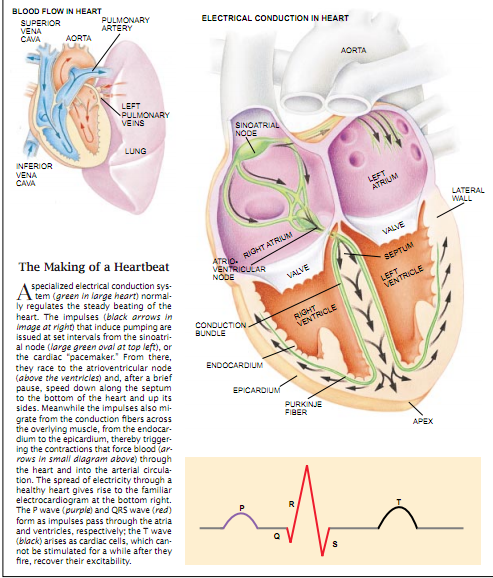
心跳的产生
在正常情况下,一个专门的电传导系统(右大图中的绿色所示)调节着平稳的心跳。诱发泵活动的心搏(右图中黑色箭头所示)是以固定的时间间隔从窦房结(即心脏“起搏器”,见右图上部绿色椭圆形)里发出的。心搏从那儿传至房室结(在心室上方),经过短暂的停顿后,沿着中隔传至心脏底部并沿着心脏侧面向上传播 。同时,心搏也穿过传导纤维上面的肌肉传播,从心内膜传至心外膜,从而引起使血液(见左小图箭头)通过心脏并进人动脉循环的收缩。健康心脏中电的传播会导致出现右下图所示的心电图。随着心搏分别经过心房和心室,p波(紫色)和QRS波(红色)就形成了;而随着心脏的细胞恢复其兴奋性,T波(黑色)出现。心脏的细胞在兴奋后,有一段时间不能被激活。
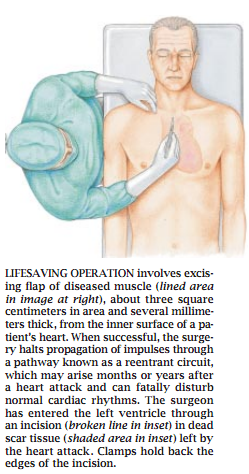
图1 救命的手术就是从病人心脏内表面上切下一片有病的肌肉(见右大图上的划线部分),该片肌肉面积约为3平方厘米,厚约几毫米。如果该手术成功,就可以阻止搏动通过被称作闭合回路的路径传播,而闭合回路是在心脏病发作几月或是几年后出现的,它会扰乱正常的心律,使人致命。外科医生从心脏病遗留下的无感觉的疤痕组织(阴影部分)上的切开线 (小图中的点线)进入左心室。夹子固定住了切开处的边缘。
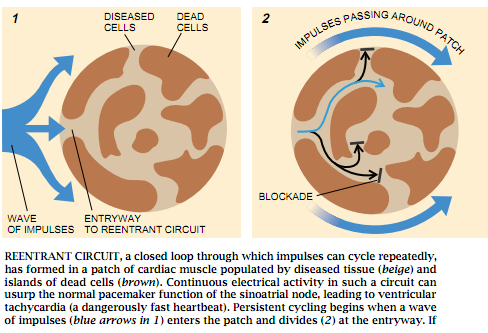
图3 闭合回路位于由受损组织(米色)和死细胞岛(褐色)组成的一小块心肌中,搏动可在其中反复循环。在这样的回路中的连续不断的心电活动,能够夺过窦房结作为起搏器的正常功能,从而引起心室的心动过速(一种极为危险的快速心跳)。随着心搏波(1中的蓝色箭头)进入这一小块心肌并在入口处分路,持续不断的循环就开始了。如果沿着一条路径(两个头的黑色箭头)流动的信号遇到了暂时的阻塞(竖线),那些沿着第二条路径(细的蓝色箭头)传播的信号则有可能通过先前阻塞的小径返回到入口处(3),或是起端。如果入口处 又重新获得了被激发的能力,返回的搏动将使这一部位重新兴奋。它们会成扇形地通过正常的心肌(大的绿色箭头),并在令人烦恼的回路中反复流动(细一些的绿色箭头)。
图 4 心脏绘图是通过一电极(蓝色)在心脏病疤痕周围的受损组织上移动而完成的,它使得外科医生能够识别出闭合回路。在一位病人身上诱发出心室心动过速时对内表面周围 12 个点(左边小图)作出的心电活动记录(右边的曲线),勾出了一个大的循环电路的轮廓。这电路由1点钟开始(即右图上曲线1处),并按顺时针方向在疤痕周围延伸。一位外科医生可以切开最早兴奋的区域(即假定的该回路的入口),从而堵塞心搏在这种回路中的传递。
图 5 用一种称作信号平均的方法得出的特殊的心电图记录了病人进行阻止心搏连续通过闭合回路的手术前(左)和手术后(右)的情况。左图那条参差不齐的红线反映出紧接在心室的兴奋后一段正常情况下应当平静的时间内有缓慢的自限制电信号通过这一令人烦恼的路径传播。手术后这段曲线变平直,说明经过这一可能致命的回路传播的电信号已被除掉。现在,信号平均的心电图能够鉴定出处于循环的心律不齐危机中的病人。
请 登录 发表评论