纳米技术
撰文/Nadrian C. Seeman
2003年是D. Watson和H. Crick发现DNA双螺旋结构50周年。这一发现使遗传学问题简化成了化学问题,并奠定了之后半个世纪生命科学的基础。今天,成千上万的研究者正在努力工作,试图破译基因控制生物体发育及机能的秘密。而所有这些基因都记录在DNA这种媒介上。
然而,除了生物化学,这种特殊的分子还有其他用途。通过现代生物技术,我们可以制造出很长的DNA分子,上面排列着根据意愿选择的构建模块序列。这为DNA的应用开辟了广阔的新天地,而不仅限于自然界中生物进化的领域。例如,1994年美国南加州大学的M.Adleman证明了DNA如何被用作计算设备。而在本文中,我想讨论DNA的另一项非生物学用途:建造纳米级的器械和设备——它们的基本元件和结构只有1到100纳米大小。
这种元件有着许多潜在的应用。DNA制造的规则的栅格能够有序地容纳多个生物大分子,以便用x线晶体成像术测定它们的结构,这是药物推理设计中的一个重要步骤。另外,这种栅格还可以成为搭载纳米级电子元件的平台——作为工作设备或是设备制造过程中的一个步骤。利用DNA制造的分子水平的精密元件还可制造新材料。活动的DNA元件还可用于纳米机械的传感器、开关、镊子以及更精密的机器人。
分枝状DNA
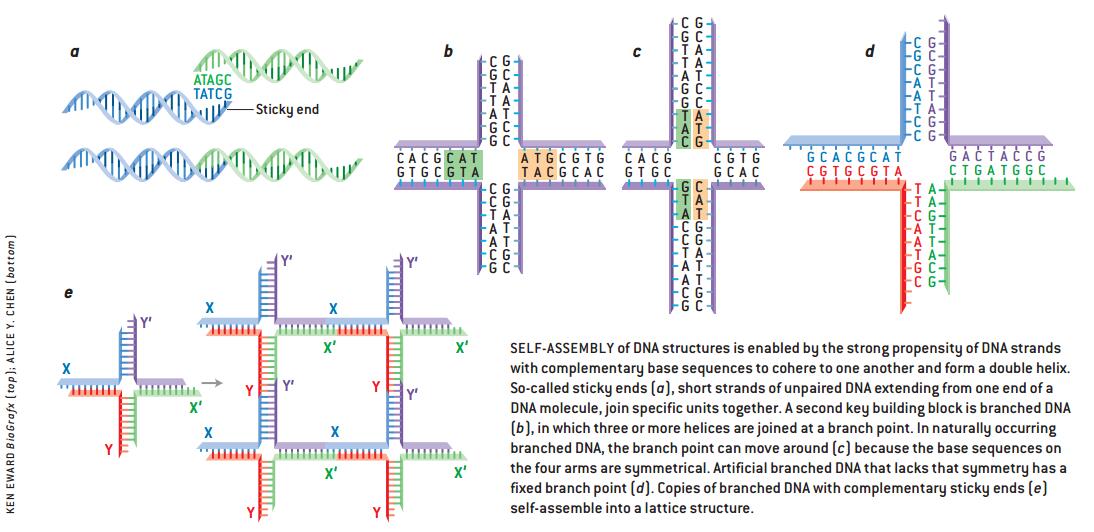
“纳米级”指的是分子水平。通常两个原子之间的化学键大约为0.15纳米(一纳米是一米的十亿分之一)。DNA的双螺旋直径大约两纳米,螺距为3•5纳米左右(约10个碱基对的距离)。碱基对构成了DNA梯子上的“橫木”[见39页上部的图解]。一小段DNA片断与其他化合物有着非常特殊的相互作用,这种作用依赖于碱基对的排列顺序。人们设想利用这些DNA链来认知特殊的分子,或是作为催化剂控制某种材料的成分。多年来,生物学家一直在利用DNA的认知特性,尤其是遗传工程学中的“粘性末端”的应用。当双螺旋中的一条链比另一条多延伸出几个未配对的碱基时,粘性末端便产生了[见39页下部的图解]。通过粘着,突出的部分与另一条有着互补碱基的DNA链相结合。对应关系为:一条链上的腺嘌呤碱基[A]与另一条链上的胸腺嘧啶碱基[T]相匹配,胞嘧啶[C]则与鸟嘌呤[G]相匹配[有关DNA粘性末端的另一应用,参见本刊2002年第5期《神奇的DNA微阵列》一文]。
乍一看,好像DNA并不能生成令人感兴趣的器件。天然的DNA形成一条直链,像一条长绳,以至于每个人都设想由它造出的东西不是直的就是圆的,但是直链不是DNA存在的唯一形式。在细胞内某个过程中,DNA主要以一种分枝状的大分子形式存在。这种分枝结构发生于DNA复制(为细胞分裂作准备)和重组(遗传物质在配对的染色体之间交叉互换,就和精子卵子形成时的情况一样)阶段。
这种分枝结构形成于DNA双螺旋部分解旋成为两条单链时。复制过程中,每条单链沿着它的全长添加相对应的核苷酸,成为新的双螺旋(核苷酸是碱基与双螺旋骨架相应部位的结合点)。更有趣的是重组过程中发生的交叉互换,其间两条DNA断裂并部分解螺旋,四条DNA链接在一起形成有些类似交叉路口的结构。
DNA重组过程中,在分枝点四条DNA链与原先相匹配的位点分离转而与另一条链匹配。由于两侧的碱基序列相对称,分枝点四处游走(就像数字69—样)。这种对称性意味着每条链可以与另外两条中的任一条相匹配。1979年我和美国华盛顿大学的H.Robinson—起工作,试图描述这种运动过程的特性。当时我意识到,人工合成的DNA分子由于缺乏这种对称性,可能形成分枝点不再游走的分枝状分子。要设计这样一个节点,需要合成4条DNA链。每条链上,半条的碱基序列要与另一条的一半相匹配,剩余的半条要与第三条链的一半相匹配[见39页下部的图解]。
DNA最适宜的结构是Watson和Crick确认的传统双螺旋结构。自由能的大小决定了那种结构是最合适的。一般来说,自由能决定一个化学反应是顺向进行还是逆向进行;它还决定像DNA、RNA、蛋白质这类大分子的空间结构——折叠与连接。一套化学体系总是趋向于向自由能最低的状态转化。对于两条互补的核苷酸链,当它们相互配对组成双螺旋时自由能是最低的。
我们分枝点固定的四条链仅仅通过组成枝状分子就可以形成传统的DNA双螺旋结构。通常,枝点并不是一种合适的状态——它增加了分子的自由能——但是普通双螺旋结构DNA组成的四条臂中储存的能量要远远超过它。今天,合成这样的DNA链并实现稳定枝状DNA分子的想法是很简单的事情,但是在1979年,它是最前沿的化学难题。当时我是一个晶体学家,而不是有机化学家,因此我至多只能考虑系统的问题。直到1982年,我才学会如何合成DNA。
来自木刻版画的灵感
我推断产生拥有多条臂的枝状DNA分子节点是可行的,而不仅仅是四条。1980年秋的一天,我去校园内的酒吧考虑六臂节点的问题。由于某些原因,我想到了荷兰艺术家M. C. Escher的木刻版画“深度”。我意识到画中每条鱼的中心就像一副六臂节点的理想图。六条线从鱼的中心点向外延伸:头、尾、背鳍、腹鳍、左鳍、右鳍。那些鱼像分子晶体中的分子一样排列着。前后上下左右有规律地重复。我灵光乍现:如果我利用粘性末端把节点联在一起,就能够在纳米级别上组合物质,像Escher用他的想象力把鱼连在一起那样。
我们有诸多的理由希望制造出这样的器件。首先,我们打算制造一些肉眼可见的物品,它们由设计好的分子组合而成,精度控制在纳米级别。通过这套方法将可能产生具有新奇特性的新材料。例如,像光子晶体这样具有光学特性的材料,就可以通过构建精密设定的特殊重复序列来制造[参见本刊2002年第4期《光子晶体:光半导体》一文]。
另一个目的是利用DNA作为平台,使其他分子保持一定的序列,包括哪些不能独立形成规则晶体结构的分子。用这种方法,我们就能够构建DNA组成的骨架,其内部容纳诸如蛋白质之类的生物大分子,从而合成用于晶体学实验的晶体[见本页右图]。这种骨架使晶体学家能够判定其内所容纳分子的三维结构——这是药物理论设计中的一个关键步骤,因为药物必须与靶分子的特定部位紧密啮合。正是晶体学领域的这种应用,强烈地激发了我对这一领域的兴趣。现在,很多有望成为极好的药物靶向的受体分子,在传统晶体学领域仍然没有得到研究。利用类似的方法,人们可以把纳米级的电子元件组装到非常小的存储器中,就像Robinson和我1987年设想的那样,我的小组还没有用DNA作为搭建平台,不过我们已经有了许多其他成绩,正一步步地向这一目标迈进。
为什么要把DNA用于这些目的呢?主要的原因是DNA链相互作用的可控性和可预期性。一个有N个碱基长的粘性末端就有4N种可能的碱基排列方式。这种庞大的可变性以及末端仅与密切匹配的序列相结合的特性,为我们将大量的DNA链以完全特殊的方式连接在一起组成所需要的大分子提供了充分的可能。此外,我们知道两个粘性末端一旦相结合,就会形成典型的双螺旋结构,而且这种螺旋结构相当固定。因此,我们不仅能知道哪条链与哪条链相连,还能知道相连节段的具体形态。我们没有蛋白质和抗体的此类特定信息——它们是另外的候选研究对象。它们也有着庞大的可变性,但是决定蛋白采用哪种形态,两种蛋白或抗体如何连接在一起是一个复杂的问题,不得不针对每个个例再单独研究。

另一个施工DNA的理由就是利用生物技术产业的设备合成DNA非常简单。我们可以利用很多酶类对DNA进行操控,例如剪切酶(在特殊位点切断DNA)或是连接酶(促使两个分子通过共价键相连——由原子间共用电子对组成的牢固化学连接)。这些设备可以用于合成及操控常规的DNA和一些特殊的衍生物。四种不同的常用碱基被连结在一起,额外的分子被附在DNA骨架的外侧(DNA梯子的两边)。希望将核酸用于医疗的医学研究人员已经合成了许多这样的变形体。DNA极为适合合成这种衍生物,因为螺旋上的每一个核苷酸都有供其他分子附着的位点。

最后,正如我们下面将看到的,DNA可以形成不同于标准双螺旋的其他结构。我们可以制造纳米级的机械设备,当DNA的结构发生某种转变时,设备的某部分就会运转,比如说可开合的镊子或是旋转轴。有一个缺点就是DNA构建必须在水溶液中制造,但是想把(例如云母上的)成品变干并不成问题。
棒状模型
任何新的科学研究计划的第一步是确定该方案的可行性。1991年,我和美国特拉华大学的陈江辉(音)通过构建一个类似棒条组成的立方体DNA分子证实了这一点[见图解]。这个立方体的每个边都是一段DNA双螺旋,每个顶点都是一个三臂节点,且与周围的三个顶点相连;也就是说这个立方体的连通度是三。基因工程学家制造了很多线性的DNA分子,但这是第一个有两个以上连通度的DNA分子。这个立方体由单个的DNA链自行装配而成,这些DNA链能彼此粘附,但是其末端不会结合在一起。连接酶可以把这些游离末端连在一起成为六个闭合的环,每个环即是立方体的一个面。由于DNA的螺旋形,每个环都和相邻的环缠在一起。因此,即使碱基对之间的连接由于某种原因被全部破坏,立方体也不会解体。
我和美国巴克斯特医疗中心的张宇文(音)制造了另一种分子,它像一个截短了的八面体,虽与立方体类似,但是更为复杂[见36页图]。虽然三臂节点就能够建立单个的截短八面体,我们还是选择了四臂节点。我们希望每个节点伸出来的一条臂能把八面体连接在一起成为一个更大的结构,但是最终我们没有在这个方向上走下去。我们仅仅制造了极少数量的截短八面体。虽然足以描述它们的结构,但是数量太少以至于无法将其连接在一起。甚至制造那些微量的样本,就已经达到了我们没有改进流程(例如使重复步骤自动化)情况下的极限,于是我们将目光投向了更为简单的元件。
更换研究方向的另一个原因是,我们在研究过程中发现所制造的多面体不够坚硬。DNA是一种刚性分子:一段2、3圈螺旋长的DNA链(我们用于多面体边长的长度)沿螺旋的轴摆动的幅度。这种刚性保证了多面体的边足够坚硬,但是我们发现每个顶点的夹角太容易改变。我们所建立的模型就像是边角插上了牙签的软糖。这种结构或许有用,但想用它的构建规则的栅格显然不行。用砖块样的元件自行装配成一种有序的晶体样物质要比用软糖容易得多。
为了解决这个问题,我们小组检测了另一种生物重组系统中发现的分枝状模型:DNA双交叉(DX)分子。这种DX分子由两个并排连结在一起的双螺旋组成,两者之间由短链交叉相联[见本页框图]。我们研究了这种分子,发现它很牢固。我们还发现一种包含另一小段双螺旋区域的DX分子(称为DX+J分子)也很牢固。这段额外的双螺旋区域在DX分子的顶端形成了一个突起,它可以用来标记——等效于纳米水平的涂料。
在我的美国纽约大学研究小组工作的刘福荣(音)和A. Wenzler,与美国加州研究所的Winfree合作,用连在一起的DX和DX+J分子作为瓦片,制成了具有特定图像的二维晶体。这些瓦片通过螺旋上的粘性末端连接在一起。DX瓦片和DX+J瓦片交替排列,形成了一个间距32纳米的条纹图案。我们将此条纹阵列放在平整的云母片表面,用原子显微镜观察以确认它的二维性。我们还将每三个DX瓦片与一个DX+J瓦片相连,形成间距加倍的另一种条纹状晶体,从而正是这种图像的产生并非偶然。

最近,美国杜克大学H. Reif的小组展示了利用这种构想支撑的“DNA条形码”。条纹被编排在这些瓦片序列当中,代表数字01101(类似于我们的DX和DX+J分子,分别代表0和1)。他们用一段编码01101的输入DNA链设计条形码。与DX和DX+J分子类似的模块分别在代表0和1的DNA链相应区域进行自我装配。许多这种五模块序列并列连接在一起,组成了代表01101的条纹图案。条纹间距约15纳米。用原子显微镜检测这些条文,人们可以有效地利用条形码读出输入DNA链上编码的信息。这种可视方法能够极大提高利用DNA计算时的数据读取速度,并且可以用于匹配转换。
我与美国普渡大学的毛承德(音)已经利用与棒状多面体类似的平行四边形DNA做出了二维图像。多个平行四边形连接在一起形成一种像空心饼干一样延伸的二维晶体。我们可以通过改变平行四边形的尺寸,来调整阵列中网眼的大小。虽然单独的枝状连接是松散的,但是把四个枝状连接放在平行四边形的四个角上就会形成平行四边形阵列当中一个稳固的单元。
纳米机械
纳米技术的核心是制造分子水平的机械。DNA已被证明在此类机械的制造中非常有用。我们已经制造了几种DNA设备,但在这里我集中讲述两种结构已经十分明确的。在这两个例子中,机械装置建立在DNA分子结构转换的基础上——从一种形态(例如常见的双螺旋结构)转换成另一种。

通常DNA分子是右手螺旋。你可以想象自己走走一段旋梯上,左手放在内侧扶栏,而右手在外侧。这样的旋梯就是右手螺旋。通常的右旋DNA成为B-DNA,它是典型的水环境中最适宜的结构。
双螺旋DNA也可依碱基序列和所处溶液化学成分的不同而呈现出多种不同的结构。其一是Z-DNA。它的结构1979年由美国麻省技术研究院的Alexander Rich及其同事首次公布[见39页上部的图解]。Z-DNA是左旋DNA结构。通常,合成Z-DNA需要一段胞嘧啶和鸟嘌呤相互交替的片段。DNA骨架中包含带负电的磷酸盐基团,在Z-DNA的结构中它们紧密地聚在一起。只有在一个含有高浓度盐分或是特殊“效应物”(比如六氨基钴Co(NH3)6+++,可以在浓度低得多的情况下起相同的作用)的水环境中,磷酸盐的电荷彼此被屏蔽,Z-DNA才趋向于这种结构。必要的胞嘧啶-鸟嘌呤序列使我们得以控制B-Z转换在DNA分子的何处发生,环境条件是我们得以控制这种转换何时发生(从而决定机械何时开始工作)。
我和纽约大学的同事孙伟琼、沈志勇、毛承德(音)制造了一个由两个DX分子组成的装置,这两个分子以一个双螺旋DNA为轴相连接[见本页图]。在轴的中间是一段20个碱基对的序列,它在合适的条件下可以转变成Z型结构。在通常情况下,装置的每一部分处于B-DNA状态,两个DX分子都在轴的同一侧。当把六氨基钴加到溶液中,轴的中心部位转变成Z-DNA状态,一个DX分子相对另一个DX分子大约旋转3.5圈,多出的半圈意味着两个分子现在处在了轴的两侧。将六氨基钴取出,装置又会变回原来的结构。我们在DX分子上附着了两个染色分子,通过光谱学检测证实了这一运动的发生。

这种B-Z装置相当有活力,但它也有一个缺陷。如果很多的B-Z装置组合在一个庞大的装置中(比如之前提到的二维栅格),整个装置只能有两个状态:每个元件都处于B型,或者每个元件都处于Z型。要想独立地控制多个元件,需要有不同的能单独触发的装置。当然,DNA可以很自然的实现这一点——利用DNA片段作为触发器,每个元件用不同的碱基序列触发。
为了实现这一方案,我和严浩(音)、张小平(音)以及沈志勇(音)设计了一个系统,它可以在与不同的片段结合时改变形态。这一系统由两条平行的DNA双螺旋组成,每条螺旋在中心交叉区域变为单链。根绝加入溶液中与单链部分相结合的片段不同,交叉区域可以呈现两种不同的状态。装置的两种状态分别称为PX(平行交叉)和JX(并列)。当装置处于PX状态,中心结合点一侧的两条螺旋会从JX状态下的位置旋转大约半圈。
通过在溶液中加入一对特殊的片断(称为调控片断)与中心区域互不交叉的结合,可以使装置变为JX状态。要变为PX状态,我们必须首先移走这些调控片断。2000年,Bernard Yurke和美国朗讯科技公司的同事证实,一条单链片断通过与完全互补的片断相结合,可以从DNA分子中剥离下来。为了实现这一过程,我们的调控片断保留了一小段与装置不配对的末端。当我们在溶液中加入与之完全互补的片断时,它先与未配对的末端相结合,再将剩余部分的调控片断逐渐从装置上剥离。

当第一组调控片断从装置中移除后,我们就可以加入另一组调控片断与中心区域结合并在此交叉,使两条双螺旋发生转动,装置变为PX状态。通过移除第二组调控片断再加回第一组调控片断,这一过程又可以被逆转。以这种方式,两条双螺旋就可以根据我们的意愿转变状态。通过加入或移除针对特定结合区设计的“”个性调控片断,多个不同的PX-JX装置就可以进行独立的操控。
我们利用原子显微镜来检测这种装置如何运作。我们将多个装置连成一条长链,每个装置的一端连接一个很大的梯形DNA聚合物。当所有装置都处于PX状态时,梯形位于长链的同一侧。当装置全都处于JX状态时,梯形呈之字形分布于两侧。

2000年,Yurke及其同事展示了三条DNA链做成的纳米镊子。调控片断控制镊子的开合。另一些研究人员已经将类似的方法用于激活核糖酶(一种用RNA合成的酶)的活性。1998年,美国德州大学奥斯汀分校的P. Robinson和D. Ellington展示了活性增强1万倍的核糖酶,他们加入适当的调控片断与核糖酶结合,从而改变了酶的结构。

对未来的展望
基于DNA的纳米技术的一个重要目标是将此成果扩展到两三个领域。如果能够成功的话,我们就可以通过列出一系列DNA序列并对它们加以组合,从而设计出固体材料。如果这种结构高度有序,那么利用前面提到的规律重复栅格框架容纳大分子进行晶体学实验就变得可行了。
DNA纳米技术的另一个目的,是将DNA原件组装到框架结构当中。它的完成将是制造具有复杂运动和多种结构状态的纳米机器人的第一步,后者将能使我们建造化学装配线。应用类似于这里描述的装置,我们可以高精度地装配新材料。作为一个样本,我与纽约大学的W. Canary及S. Lukeman、德州大学奥斯汀分校的朱雷(音),最近在核酸链骨架上聚合了一小段尼龙。我们期望有一天能够合成有特殊性质及拓扑结构的新聚合物(例如其骨架上的缠绕物)。
要实现这些目标,首先需要将DNA作为可设计的成分。但无论晶体学还是纳米微电子技术都不能仅依赖于DNA。比如纳米金属粒子或纳米碳立方体等纳米微电子元件,必须在特定的反应体系和液体环境中与DNA分子相结合,同时既要与DNA又要与其他成分相谐调。考虑到这些分子复杂的化学特性,实现这一目标并非易事。即使通过DNA的自行装配创立了纳米微电子学,纳米机械最终仍需以比在溶液中加入、移除调控片断更为复杂的方式与宏观世界相互作用。这一挑战很可能充满艰辛。
理想的纳米机械应该能够复制。然而不同于线性DNA链,枝状的DNA链不具有自我复制功能。但去年的晚些时候美国加州的Scripps研究所的M. Shih、D. Quispe和F. Joyce在能自我复制的DNA分子研究上迈出了令人振奋的一步。他们用一条约1700个碱基对的DNA链制造了一个八面体,期间利用了5个辅助的短支链完成装配。这个八面体的每条边由两个彼此连结的DNA双螺旋形成(一组DX和PX分子),每边长14纳米,即4圈双螺旋。一个折叠的八面体是不能复制的,但在非折叠状态下,长链可以很容易通过PCR(多聚酶链式反应)这一标准生物技术方法复制上百万次。虽然距成功复制生命体还有很长一段路要走,但是等到Watson-Crick发现DNA双螺旋结构一百周年的时候,我们也应该能拥有达到这一水平的DNA机械了。
请 登录 发表评论