生物学家通过把关键的人类基因引入哺乳动物中,能够引致乳用动物在其乳中生产治疗性蛋白质。

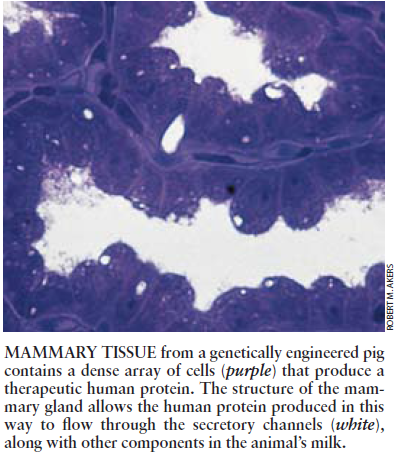
我们的实验母猪Genie刚好在自己出生一年之后。就在平静地哺乳7只健康的小猪仔。她的奶为这些后生提供了生存和生长所需的许多营养。但是与其它的猪不同,Genie的奶中还含有某些危重病人所极度渴望得到的一种物质:人体C蛋白。为患者获取这种血蛋白的传统方法包括加工大量捐献的人血或在大的不锈钢反应器中培养大量的细胞。然而无需明显的帮助Genie就会生产大量的C蛋白。她是世界上在其乳汁中生产人体蛋白的第一头猪。

Genie以这种方式制造一种治疗药物的能力是几乎十年所设想的一项研究计划的结果。在与专门提供这种血蛋白的美国红十字会科学家的合作之下,我们开始考虑改变动物乳汁组成以包含某些这类迫切需求的物质的可能性。在理论上,这种方法能够产生经常都是供不应求的任何需求数量的各种治疗性血蛋白。
对这种药物的需求来自许多方面。例如,血友病患者可能缺乏所有几种不同的凝固剂,特别是称为Ⅷ因子和Ⅸ因子的血蛋白。先天性缺乏的某些人需要额外的C蛋白(它起控制凝固的作用)以补充他们体内贮存的不足,进行关节复位外科手术的患者也能从这种蛋白中获益。需要治疗性血蛋白的另一个重要例子包括患中风或心脏病发作的人,这些病例往往要求用称作组织血纤维蛋白溶酶原活化剂(能够溶解血块的一种物质)的一种蛋白质进行快速治疗。此外患衰弱形式的肺气肿的某些人输注叫作α-1-抗胰蛋白酶的一种蛋白质能够更加容易地呼吸。
所有这些蛋白质仅以很小的数量存在于捐赠的血液中,因此他们当前是如此难以生产以致它们的费用阻止了或严重限制了它们作为药物使用。例如,用纯化的Ⅷ因子进行治疗(仅限于有血友病的人实际上正在出血的那些时候使用)一般每年耗去患者数万美元。在同一期间连续替换这种血蛋白质一一一种合乎需要的但极少实施的选择——的费用应超过10万美元。
这庞大的数目反映出了许多的问题包括从捐献的血液中萃取这些蛋白质或建立利用培养细胞的专门生产工厂——可能需要2500万美元或更多投资的一个企业,以提供数量不多的一种蛋白质。开发如Genie这样的“转基因”动物(这是一种带有其它物种基因的生物)仅需要上述成本的一小部分:然而这种新的育种大大简化了程序而且能够生产巨大数量的人血蛋白。因此用转基因家畜代替常规的生物反应器可提供巨大的经济效益。
以这种方式产生血蛋白也胜过目前所采用的其它措施一一从捐献的血液中纯化它们—因为它能够避免受传染性病原污染的危险。虽然现在从混合的血浆得到的血蛋白被认为是相对安全的;献血者经过仔细的筛选,并按惯例采用了灭活病毒的处理,但来自某些病原的威胁往往隐隐呈现。例如,害怕因粗心而扩散的HIV(艾滋病的致病原)和丙型肝炎病毒正促使研究人员去寻求现在由人血而获得的药物之替代物。相似地,近来对克-雅氏病(神经系统的一种退化性疾病)的关心已引起美国和欧洲取缔某些血液制品,用已知没有这些疾病的转基因家畜制造人体血蛋白应能巧妙地回避这些困难。
由应用转基因动物作为生物反应器产生的许多利益给了我们足够的理由去营建携带少数关键性人类基因的健康家畜的整洁饲养场。但是在我们的研究开始时,面对着我们在培育这种转基因动物和从它们的乳汁中积累可用数量的蛋白质在技术上的障碍,我们有许多耽心的问题。幸好,我们能够取得迅速的进展,并从已经作出的许多开创性研究中获益。
先在周围寻找
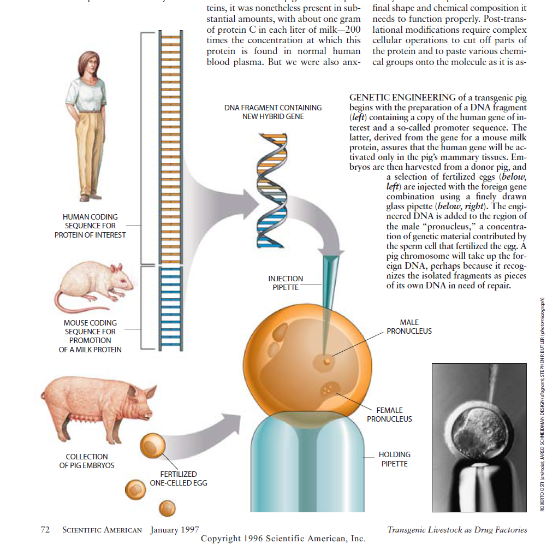
早在1980年、耶鲁大学的Jon W.Gordon及其同事已确定、一个已受精的小鼠胚胎能够把外来遗传物质(DNA)结合到它的染色体中——细胞的遗传物质“仓库”。此后不久,俄亥俄大学的Thomas E. Wagner及其同事证明,从兔中获得的一个基因(为一种特定蛋白质编码的DNA节段)能够在小鼠中起作用。这些研究人员应用情细控制的显微尺寸玻璃管发明了把兔DNA的特异断片注入单细胞鼠胚胎的方法。令人惊异的是、那种DNA往往能整合到鼠的染色中,或许是因为它被这个细胞认作必须被修复的一点DNA断片。
然后这些研究人员把这个经注入的胚胎植人代替母鼠体内并发现,她所发生的一些小鼠在其全部组织中都含有那个兔基因。这些转基因鼠又把这个外来基因按照孟德尔的遗传定律以正常的方式传给它们的后代。这个加人的基因在其新宿主中正常地发挥其功能,而且这些小鼠在其血液中制造免血红蛋白。
通向转基因动物生物反应器道路的另一个里程碑发生于1987年。国立肾病和消化道疾病研究所的Lothar Hennighausen和动物生理和遗传研究所苏格兰爱丁堡研究站的A.John Clark分别与他们的同事一起确立了在鼠的乳腺中活化外来基因的方法。然后,以这种方式产生的外来蛋白质分子被直接分泌到转基因鼠的乳汁中,很容易从这些乳汁中采集外来蛋白质分子。这些研究人员通过把有利的外来基因与一般起活化鼠乳蛋白基因作用之DNA的短片段结合在一起而完成了这一丰功伟绩。
Hennighausen的鼠生产的所需人体蛋白(在那种情况下为组织血纤维蛋白溶酶原活化剂)为令人失望的低浓度,而Clark的鼠在每升乳汁中生产23克绵羊乳蛋白(已知为β-乳球蛋白)一一其长度近似于可与鼠自己的主要乳蛋白相匹敌。然而β-乳球蛋白并非是供应短缺的一种人体蛋白,这些细小的鼠也不是提供有用数量乳汁的适合的媒体。因此Clark及其同事继续研究在绵羊胚胎中注人含有药物上重要性的人类基因之DNA。
他们利用为凝血因子(Ⅸ因子)编码的基因、以及一般开通乳腺中β-乳球蛋白生产机制的绵羊DNA的一个断片。两年后,Clark的转基因绵羊在其乳汁中分泌Ⅸ因子——然而其水平几乎是不可检测的,正是在那个时候我们开始了我们实现这种开拓性研究的可能性的努力。但是我们决定冒一次险并试图采取一种新的策略。
瞎弄一气
鉴于其它研究小组已选择绵羊、山羊或母牛作为生产人体蛋白的合适乳用动物。所以我们代之以选择猪进行研究。猪具有妊娠期短(4个月)、生育期短(12个月)和每窝产仔数多(一般为10至12头仔猪)的优点。因此,与转化其它种类的家畜相比,生产转基因猪是相对较快的。此外尽管它们未被公认为乳用动物,但猪确实生产相当多的乳汁:一头泌乳猪每年约产300升乳。对于我们来说真正的问题在于,转基因动物的这种非常规的选择实际上是否能在它的乳汁中生产可观水平的人体蛋白。
为了实现那种结果,我们决定应用Hennighausen及其同事鉴定过的由一个人类基因和小鼠的一种主要乳蛋白(称为乳清酸性蛋白)的所谓启动子构成的DNA节段。通过把这种DNA组合物注入鼠胚胎中,这些研究人员能够增进鼠的染色体,以致这种生物能够在其乳汁中产生所需要的人体蛋白。我们也利用这种方法的优势构制了DNA的一种断片,它含有目标蛋白质(在我们的情况下为C蛋白)的人类基因和乳清酸性蛋白的鼠启动子。但是我们把这种DNA注入一组猪胚胎中。
通过把这些已受精的细胞植入一头代理母猪中,我们能够鉴别一一紧张地等待4个月后—在其所有的细胞中都携带有这种外来DNA的新生雌性猪仔。但是即使有了这一成就,我们还是必须再耐心地等待一年直到我们的转基因猪仔Genie成熟。只有在那时我们才能弄清楚她在其乳汁中实际上是否能生产人体蛋白。令我们十分高兴的是,Genie的乳汁中含有C蛋白。虽然人体蛋白不是如该猪自己的某些乳蛋白那样丰富,但它是以相当大的数量存在,每1升乳汁中大约含1克的C蛋白——其浓度为正常人血清中所发现的这种蛋白质的200倍。然而我们也是急切地要知道这种猪制造的人体蛋白是否是具有生物活性的。
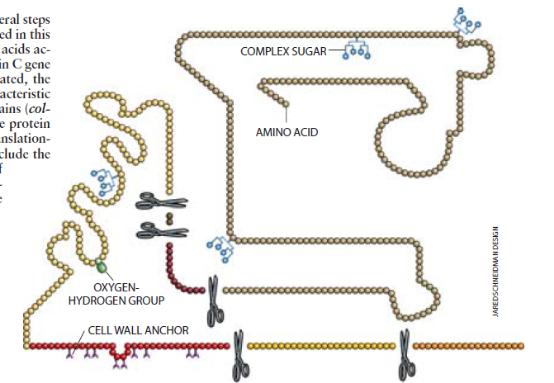
我们之所以很担心是因为细胞内蛋白质合成的详情仍然有某些神秘的东西,细胞机器的运转以读出遗传编码和把那种信息转换成氨基酸序列——蛋白质分子的构建单元——绝大部分已被生物学家完全弄清了。但是也有一些微妙的操作。在氨基酸结合在一起后必须由细胞来进行。这些所谓的转译后修饰为新构建的蛋白质分子带来最后的形状以及正确发挥其功能所需的化学组成。转译后修饰需要复杂的细胞操作以切下蛋白质的成分并在它被组装时粘贴不同的化学基因在这种分子上。Genie的哺乳组织细胞将能够很好地进行这些修饰从而足形成人体血蛋白的一种有效形式吗?
为了确定这答案,我们必须解决从猪乳中分离人体血蛋白的新问题。首先我们通过离心除去乳脂。然后我们用只萃取人体蛋白的生物活性部分的一种方法纯化剩下的乳清。使我们十分惊奇的是,这些成分占所存在C蛋白总补体的约三分之一。以前从未从一种转基因动物——或从一个常规的生物反应器中——生产和收获过如此高水平的功能性C蛋白,Genie己通过了一个大型试验,提供了第一个实践证明证明在家畜的乳汁中能够生产复杂的人体蛋白。
下一年的模型?
我们花费了几年时间去研究Genie和许多她的现存的后代,然后开始把我们的精力集中在提高乳汁中活性人体蛋白的浓度上。我们的目的将是克服乳腺组织在进行所需的转译后修饰的局限性。原则上,突破这些最后障碍能够使生产的有用蛋白质分子之产量增加两倍。
随着对这一问题的某些煞费苦心的研究,我们发现,大多数C蛋白保持为一种未成熟的、非活性的形式,因为在这些细胞内名叫furin的一种关键的加工酶(它本身是一种复杂的蛋白质)数量不足。因此,我们立即问我们自己,通过引入另一种外来基因(即允许制造更多的所需加工酶的基因)我们是否能改进这种状况。
为了快速试验这种可能性,我们暂时地把我们的研究从猪转向鼠这种大多数转基因哺乳动物试验的快速育种支柱。1995年我们在生物工程培育转基因鼠系方面获得了成功,这种鼠系含有两个人类基因一一一个为C蛋白基因,另一个为furin基因。我们设法把这两个转基因通过将其附着到先前我们已参入Genine的DNA启动子上而接到乳腺中。
经在实验室中数月的漫长努力,我们欣喜若狂地发现,这些鼠在其乳汁中能够分泌成熟形式的C蛋白。因此我们开始开发含有C蛋白和furin两个人类基因的新的改良转基因猪我们希望很快可看到生产的活性C蛋白为Genie的3倍的猪,而且我们预料研究转基因家畜的其它研究人员也将能够形成引起加工酶以及目标蛋白质生产的基因修饰。
幻想的前景
仅在不久以前对以合理的成本获得实际上无限数量的稀有人体血蛋白的想法还似乎是纯粹的幻想。二十多年来,分子生物学家和生物化学工程师努力克服从大规模细胞培养工厂生产甚至数量不多的人体蛋白中出现的问题。然而在巨大的不锈钢容器中生产遗传工程细胞的生物药物似乎肯定始终是一个棘手的和费用昂贵的任务。
这种生物反应器需耗巨资构制,而且它们已被证明在操作中对细胞在其中生长的培养基的温度和组成方面的微小变化都极为敏感。相反只需培育更多的动物就能够产生转基因家畜生物反应器。转基因家畜只需要常规的注意以控制它们的生活条件和营养供应,而它们却能很容易地比它们的金属对应物生产浓度大得多的所需蛋白质。
虽然存在着某些危险,即病原可从家畜传递给人,但正规的程序可以用来建立无已知疾病的纯种动物。事实上,这种无特定病原畜群是农业养殖十分成熟的一部分。此外,数十年在临床上应用猪生产治疗糖尿病的胰岛素使我们有信心:猪能够容易地起治疗用人体蛋白的生物反应器的作用而不会出现不适当的危害。
仍然像所有的新药一样,以这种方式生产的人体蛋白,在政府批准它们广泛使用之前,必须对其安全性和有效性进行仔细的测试。仅在几个月前开始了首例这种考查(用转基因山羊由Genzyme转基因公司制造的叫作抗凝血酶Ⅲ的一种抗凝结蛋白质)的临床试验。
很有可能,在以这种方式进行转译后修饰在动物细胞和人细胞之间的微妙差异可能影响这种蛋白质在人体内如何发挥功能。例如,某些修饰引起肝脏很快从血液中清除蛋白质,因此我们怀疑,动物和人的这些蛋白质形式之间的某些差异实际上能够以这些物质作为长寿命治疗药物的方式有所改进。
人们很想把转基因家畜生物反应器的开发纯粹看作技术上的成就。但是这一科学的历史也强调了人们用复杂的机器所能作的事物的局限性。保持细胞的高密度、向它们传送丰富的营养供应和把生产的有价值蛋白质经管道引人容易收获的形式,乳腺是最佳的。乳腺组织被证明远优于任何细胞培养器,即使是为这些任务而特别设计的培养器。尽管它们作了改进工业化细胞培养设备的种种努力,但已经知道,一代生化工程师们不能与自然界已经琢磨成的蛋白质生产工具的能力相匹敌。
对于Genie来说有什么好处
控制家畜的转基因技术的发明也对以这种相当异端的方式改变的动物之健康和福利带来了是否合理的关心。总之,我们移植到猪胚胎中的这种遗传工程“转基因”最终能够变为成熟动物的每个细胞的一部分。如果一个引入的基因不适当地起作用并以损伤周围组织的一种方式生产这种外来蛋白质那又会怎么样呢?
这种担心使我们的遗传操作设计变得十分重要,以便这种外来基因将只在乳腺中被激发起作用—即在有生产和输出蛋白质的天然能力的组织内而不伤害组织自身或它们的宿主。我们可望在我们的转基因猪中实现这种蛋白质生产的目标控制,因为我们使用了来自一个乳基因的启动子——存在于所有哺乳动物的一种遗传开关。
然而我们认识到甚至这种表现很好的基因能够显示某些杂乱的活性。例如,我们引入猪内的这些基因也在该动物的唾腺中生产少量的外来蛋白质。实际上这些组织在组成上与乳腺组织十分相似,因此我们完全预料到了这种不必要的生产。同时我们十分肯定,这种次要的副作用不会以任何方式伤害这些猪。
没有不利的副作用是很关键的—对于所涉及到的动物以及对于这种开拓性方法的成功来说都是很关键的。开发转基因家畜以供应人体蛋白的主要理由之一是限制把疾病传递给这些药物的接受者的可能性,除非采用最健康的家畜生产这些物质。否则会增大这种动物对疾病的敏感性以及增大它们偶然传递某些未知病原的可能性,因而在最终如果遗传工程弱化了家畜这只能证明生产安全和丰富药物的这项研究的自我失败。
(刘义思 译 王世德 校)
请 登录 发表评论