究竟是什么引发了癌症?
![1506055421325861.png $YD6`$QK]@[P2GS@V{@VD]0.png](/resources/image/20170922/1506055421325861.png)
癌症的根源必须要与发病存在必然的因果关系。
癌症的直接根源必定是某种细胞破坏与意外结合,由此导致人体的正常细胞恶化。事实上在10年前,就有科学家坚信科学研究正在接近谜底:癌症是突变聚集的结果。
然而包括数位非常著名的肿瘤学家在内的其他科学家,正在逐渐挑战这种理论。癌症本质上是一种DNA疾病,这点没有人怀疑,但当生物学家追踪它的根源时,他们发现,细胞核内存在许多虽末癌变却有癌变趋势的其他异常情况。所有的染色体(每个包含1000个以上基因)经常整体地丢失或被复制,染色体片段经常杂乱地拼接、删节或粘合在一起。加在DNA或螺旋体周围组蛋白中的化学物,能够压制一些重要基因,但采取的是一种与突变有很大区别的可逆方式。
这些积累起来的证据,产生了至少3种与标准法则竞争的假说,这些假说解释了细胞从良性组织到恶性肿瘤的长达10多年的转化过程中哪些改变首先发生,哪些变异起着最重要的作用。他们质疑把癌症定义为遗传性状态的统治观点,认为把它看作一种无序过程的结果更有用,他们把墨菲定律和达尔文理论合二为一:任何事物都可能出错,竞争使适应环境者得以生存。尽管几个新理论的基本原则相同,但它们对什么是最有效的癌症治疗方法却提出了不同的预期。有人提出,综合更好的体检、饮食习惯的改变、以及新药的使用(甚至使用如阿司匹林之类的旧药),就能够完全预防癌症。其他理论则对这种希望持怀疑态度。
恶性的标志
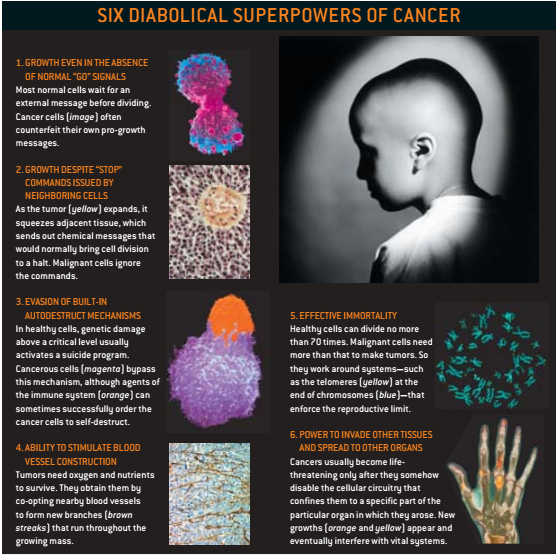
要成为一个切实可行的癌症理论,不但要解释为什么癌症主要是老年性疾病,还必须解释为什么我们不都死于这种疾病。一个70岁老人比一个19岁年轻人患癌症的机率要高约100倍,但是大多数人能够活到老年而不得癌。
生物学家估计,在一个人80年的生命过程中,必须有一亿亿个以上的细胞来协作维持他的健康。如果无数细胞中的任何一个都可能致病,那为什么只有不到一半人口的肿瘤才严重到足以引起医生的注意?一种解释是,一个细胞必须获得几种特别的能力才能成为恶性。美国麻省理工学院怀特黑德研究所的A.Weinberg提出:“5、6个不同的调节系统必须依次受到干扰后,才能使正常细胞生长成为癌症。”在2002年9月的一篇述评文章中,他和波士顿Dana-Farber癌症研究所的C.Hahn认为,所有威胁生命的癌症都表现出至少6种特殊的能力。Weinberg是标准模式的创立者之一,但那些反对他理论的人,也都倾向于支持他的这种观点。
例如,在正常细胞通常需要安静等待某个特殊的化学信号(例如来自一个受损的相邻细胞)时,癌细胞会继续分裂。它们不知何故能伪造这些有利生长的信号。相反地,它们会不顾从受它们挤压的邻近组织以及由它们自身内部老化机制所发出的“停止分裂”的命令。
所有癌细胞都有与DNA有关的严重问题,当它们一遍又一遍地分裂时,肿块中许多细胞会远离供氧和营养的血管。这种压力引发了健康细胞的自我破坏机制,但癌细胞找到一些方式来避免这类自杀,它们促使邻近血管帮助建立生长所需的基础。
几乎所有癌症获得的第5个超强能力是永生性。正常人类细胞的培养一般到50至70代后即停止分裂,这种倍增数目即使维持一个人健康地活到100岁也足够了。但是癌症中的绝大多数细胞能很快地死于遗传缺陷,所以,如果癌肿要生长的话,那些幸存细胞必须具有无限的复制能力。这些幸存细胞可以通过操纵染色体端粒、DNA复合体以及保护每条染色体末端的蛋白质来部分地达到这个目的。
癌肿发展的这5种能力是很麻烦的,但它们一般不会致人于死地。而它的第6个特性,即侵入邻近组织并转移到身体远处的能力,是癌症的致命特点。局部侵入通常可被外科手术切除,但是每10个死亡病例有9个是转移的结果。
癌肿中似乎只有一小部分的精华细胞才能与起始肿块分离,通过循环转移并在其他不同器官中形成新的肿块。不幸的是,在它们被发现时,许多癌症已经转移了——在美国包括72%的肺癌、57%的结肠直肠癌以及34%的乳腺癌。到那时,预后通常不会乐观。
杂乱无序的规则
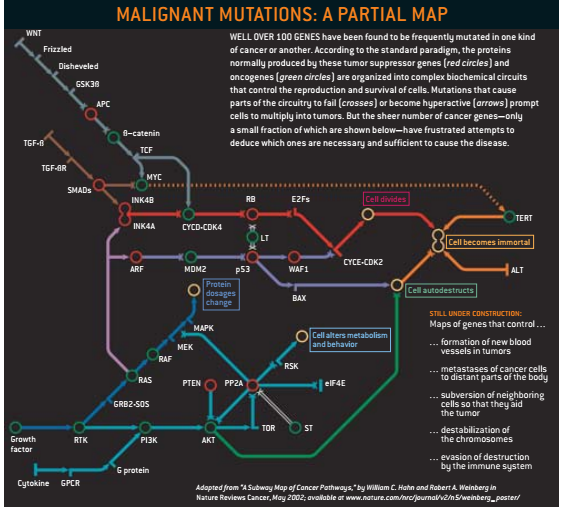
在致癌物或随机生化意外最初进攻DNA之时,细胞对此有所记录,如果科学家能够对这样的步骤进行跟踪,医生就可能更快地发现早期癌症。研究人员对出现在致癌路径中的病患细胞的特性没有异议,他们热烈争论的是诱发它的动因和各个重要转折点的顺序。
这25年来一直占支配地位的模式是,癌症以随机突变和膨胀的方式生长。细胞的遗传受损,删除或破坏了肿瘤抑制基因(最著名的有RB、p53和APC),因此,正常情况下保证染色体组完整性和细胞分裂过程的蛋白质被抑制了。换句话说,突变可以增加致癌基因(如BRAF,cfos或cerbb3)的活性,这些基因的蛋白质反过来又可刺激细胞的复制。
癌症基因的变异赋予细胞一种或多种超强能力,使得它比邻近细胞繁殖得更快。细胞将其DNA序列的异常传递给子代。正常情况下,细胞的每一个染色体都有两个副本,一个来自母亲,一个来自父亲。
这种突变基因的模式获得了普遍接受,因为它很好地解释了科学家在他们的遗传工程鼠和人类细胞培养实验中所看到的结果。然而目前新的技术允许研究人员去研究从人体直接获取的癌症及癌前细胞的基因组。最近的许多观察,看起来与癌症的根源是由几种特殊基因的突变造成的这一观点相抵触。
![1506055493167569.png `R4@`SZR0{@`K5)~BXOA]`9.png](/resources/image/20170922/1506055493167569.png)
无法解释的现象
今年4月,美国密歇根大学安娜堡分校的Al-Hajj及同事报告说,在能够形成新型肿瘤的人类乳腺癌中鉴别出了与罕见亚细胞有区别的标记物。把哪怕是少到100个这类细胞注射到缺乏免疫系统的大鼠体内,它们也会很快生病。而同样从这9个恶性乳腺组织中提取的千万个其他细胞,因缺乏这种指示标记物,就不会致病。“这是人们为实体肿瘤分离出的第一个肿瘤起始细胞。”为白血病鉴别出相似细胞的多伦多大学生物学家E.Dick如是说。
Dick认为,令人无所适从的是肿瘤中仅有一小部分细胞同它的生长和转移有关,但却是造成患者生病和死亡的原因。如果这点不但适用于大鼠,而且也适用于人类的话,这将对肿瘤的突变基因理论造成问题。如果一个细胞复制给后代的突变赋予癌细胞突变的能力,那么整个癌细胞复制群体是否会具有同样强大的能力呢?
超出突变的范围
![1506055528396022.png 1RVZ5E6Y02A$}4_]W573D~U.png](/resources/image/20170922/1506055528396022.png)
不稳定的开端
约翰霍普金斯大学的Lengauer和Vogelstein,是两位著名的结肠癌专家,他们提出了染色体不稳定性能够早期发生的另一种理论。遗传变迁与自然选择的力量相结合,导致了良性的生长,但以后可能会转变成为侵袭发生的恶性和威胁生命的转移。
在他们的理论中,存在着几种对细胞正确复制起关键作用的“控制”基因。哪怕是一个这类基因由于突变或遗传而失去功能,细胞就会在经过精密的分裂过程中出错,胡乱地将一些染色体弄成异倍体状态。结果是细胞随机失去两个等位基因中一个的速度增加了10万倍。对肿瘤抑制基因而言,一个等位基因的丢失,会有效地迫使基因不能使用,原因可能是剩余复制基因已经突变,也可能是单倍染色体不足的影响。Lengauer和Vogelstein还假定在恶性肿瘤爆发之前,一些癌基因肯定先被改变了。
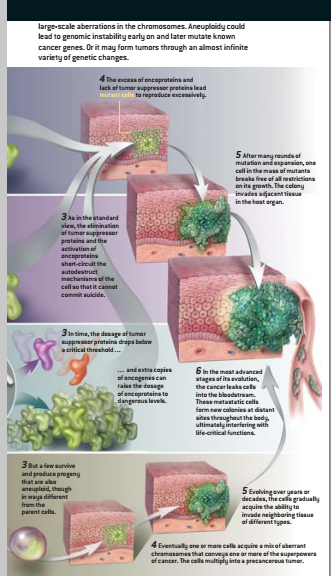
2002年12月,与美国新泽西州普林斯顿高级研究院的A.Nowak和L.Komarova一起,Lengauer和Vogelstein发表了一篇把该理论应用在非遗传性结肠癌中的数学分析。他们计算出,即使人类基因组控制基因少到只有5、6个,在一个特定癌基因受到打击之前,控制基因极有可能丧失能力。
这些计算结果很好,但只有实验证据才有说服力。最近一些研究确实支持早期不稳定性理论。2000年Lengauer的实验室检查了结肠腺瘤,它是一种偶尔转变成恶性的良性息肉,他们观察到超过90%的腺瘤至少多出或丢失一个染色体片段。一半以上丢失了第5号染色体的臂,它是APC肿瘤抑制基因所在的位置,长期以来被怀疑同结肠癌的形成有关。其他研究者在从胃、食管以及乳腺中取出的癌症前期生长物中也发现了类似的异常染色体。
但是,早期不稳定性理论仍然还有一些尚待处理的枝节问题。具有变化不定染色体的细胞如何同稳定的正常细胞竞争呢?挪威奥斯陆大学免疫学家Breivik认为,在正常情况下,它们可能无法竞争。但在“交战地带”,致癌物或其他应激物频繁地对细胞进行损害性打击,正常细胞停止分裂直到完成了对自身DNA的修复。Breivik推测.遗传上不稳定的细胞由于它们的DNA修复系统已经损坏,因此它们完全无视这种损坏、保持增生,因而超越正常细胞。
他引用了Lengauer及其同事的一个实验。该实验将人类细胞系暴露于烤肉中致癌物的有毒浓度之中,结果仅有少数细胞抵抗这种毒性而存活下来。所有的细胞在暴露于这种毒素之前都具有遗传上的不稳定性。
然而,是什么先把染色体搞乱了呢?虽然出现了几种值得怀疑的基因,但还没有一种可以被绝对地看成控制基因。美国马萨诸塞大学医学院的A.Pihan及其同事今年3月发表了一项研究,从癌细胞侵入子宫颈、前列腺和乳腺之前所发现的116例癌前肿瘤中可能发现了一条线索。30-72%的肿瘤包含有缺陷的细胞中心体,此中心体在细胞分裂过程中出现,帮助新复制的染色体从原始结构中分离出去。这些细胞大多数是异倍体,这并不令人惊讶。科学家仍在努力找控制中心体的构成和功能的所有基因,它们中的每一个都可能是控制基。
自始至终都是异倍性
另一方面,也许细胞在任何控制基因、致癌基因或肿瘤抑制基因突变之前就能够变成恶性。美国加川大学伯克利分校的Duesberg和李如红(音)提出了第3种理论:几乎所有癌细胞都是异倍体(白血病除外),因为它们都以这种方式发端。许多因素都能够干扰一个分裂的细胞,使一个子细胞获得正常数目的46个染色体,而另一个则多出一个额外的染色体。Duesberg注意到,石棉纤维可以有力地中断这个过程。
大多数异倍体细胞一出生即死亡或生长迟缓。但他提到,在不多见的幸存细胞中,数以千计的基因变异了。这就使合成和维护DNA的酶组遭到破坏。断裂现象在双螺旋结构中出现,进一步动摇基因组。Duesberg解释说:“细胞的异倍体越多越不稳定,就越容易产生允许它到处生长的新的染色体组合。”
与其他3种理论不同,全异倍性假说推测,肿瘤的出现和进展与细胞内染色体种类的联系比染色体中的基因突变更紧密。一些观察也支持这种观点。
今年5月,Duesberg与德国海德堡大学的科学家一起,报道了在正常和异倍体大鼠胚胎上进行的实验。细胞偏离染色体正常数目越多,则染色体中变异的积聚越快。基因组的不稳定性根据异倍性的程度而呈指数性递增。
美国国立癌症研究院癌基因组主任Reid从他对人类子宫颈癌和结肠癌异倍性的调查中获得了支持证据。他宣称:“坦白地说,染色体组不平衡的循环模式是存在的,举例来说,每一例(非遗传性的)结肠直肠癌患者会增加第7、8、13或20号染色体,或丢失第18号染色体。在宫颈癌中,第3号染色体的异倍性发生得非常早,这些细胞似乎具有选择有利性的特点。
Reid发现异常染色体的平均数目从正常细胞的0.2逐渐增加到转移性结肠肿瘤的12。Reid说:“因此,实际上我认为Duesberg关于异倍性是癌细胞中最早遗传变异的观点是正确的,但他又认为基因突变是不需要的,这点是不对的”。
![1506055612972218.png WTT7Z$]0SDW2%IM$(N0IWGF.png](/resources/image/20170922/1506055612972218.png)
从根源上阻止癌症
无论标准法则或向它挑战的任何新理论,都不能完全解开我们称之为癌症的100来种古怪疾病的根本症结,也不能将它们解释为某个单一机制的各种变异。所有理论都需要扩展,需要同外遗传现象相结合,这可能是关键所在,但仍然扑朔迷离。
重要的是,决定哪一种观点比其他观点更正确,因为它们都对最有效治疗常见和致命癌症的疗法作了不同的预测。依据标准观点,肿瘤有效地依附于由致癌基因产生的蛋白质并被肿瘤抑制蛋白所毒害,因此所研制的药物应能削弱依附性或供应毒素。实际上,该策略已为一些新药所使用,如用于罕见白血病和胃癌的Gleevec和用于晚期乳腺癌一个变种的Herceptin。
但现有的全部治疗,包括Gleevec和Herceptin,在部分患者中是失败的,因为他们的肿瘤发展成了一种抗性品系。Loeb担心这个问题可能没有简单的解决办法。他说:“如果我是正确的话,那么对包含大约1亿个细胞的任何已知肿瘤,将存在随机突变的细胞用以保护它们抗击你能设想的任何形式的治疗,因此你所能期待的最好结果是延迟肿瘤的生长。你不可能根治它。”
对于癌症的主要受害者老年人来说,充分的延缓可能和治愈一样有效。比减慢肿瘤生长更好的是首先延缓它的形成。如果Lengauer和其他早期不稳定性理论的主张者能成功地识别出控制基因,那么也可能研制出保护或恢复其功能的药物。Lengauer说他的小组已经给予制药工业使用细胞系的许可,用于进行药物的筛选。
如果全异倍性理论是正确的话,筛选不同种类的药物可能是最好的方法。现在还不知有什么方法可选择性地杀灭携带异常染色体的细胞,但如果活组织检查发现过量异倍体细胞,就有必要严密监控甚至根据症状实施预防性手术。Duesberg还建议应该对食品、药物和化学物进行检测,以便识别导致异倍性的化合物。
癌症究竟是由什么引起的?未来的科学将给出明确的答案,这可能是一个非常复杂的答案,并可能迫使我们把希望从治疗药物转到预防药物上来。即使不能清楚地知道癌症的根源,医生们还是发现非常小剂量的阿司匹林似乎能预防某些成人结肠腺瘤,尽管效果不很大,但以化学预防这一更好的选择来取代化疗,毕竟迈出了一步。
[王伟/译 赵晖/校]
请 登录 发表评论