一个似乎合理的假说指出,构成艾滋病基础的免疫破坏源于人免疫缺损病毒在体内连续而危险的演化。
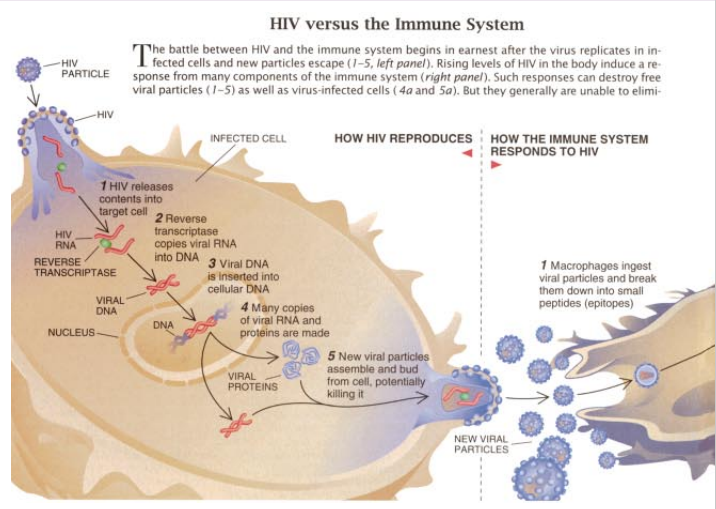
人免疫缺损病毒(HIV)和免疫系统的相互作用原来明显比大多数科学家想象的有更复杂的动态。近来的研究表明,HIV毎天大量地复制和破坏免疫系统的许多细胞。而这种生长是一般在许多年内与阻止该病毒繁殖失控的旺盛的防御应答相对抗的结果。但是,力量平衡通常最终会改变,以致HIV占上风,并引起严重的免疫损伤,将此定义为完全暴发的艾滋病。
我们已提出可能解释该病毒最终逃避免疫控制的一种演化假说,病毒感染和艾滋病发作之间一般会延迟很长时间,这种延迟的程度在患者与患者之间差异很大。大多数受感染的个体发展成艾滋病要经过10年左 右,但有些患者在感染的两年内就被诊断出发病,而另一些人在感染达15 年或更长时间都未发病。
我们认为,使许多病人多年都保持健康的强有力的免疫应答,最终却因病毒连续突变而遭破坏。正如将要看到的,在任何给定的个体内,都可能出现新的病毒变异株,它可稍微逃避防御力量。按照我们的观点,累积许多这种变异株能够打乱免疫系统,达到使之不能再有效地抵抗病毒的程度。
弄清我们为何提出这一获得临床支持的假说,会有助于了解一些关于在一般情况下免疫系统怎样消灭病毒,特别是它如何应答HIV的。当任何病毒侵入体内并定殖于细胞内时,防御力量就展开一场多刺而高度命中目标的攻击。巨噬细胞和相关的细胞吞食某些游离的病毒粒子并分解它们。然后这些细胞将一定的蛋白质片断或肽填入已知作为人白细胞抗原(HLAs)的蛋白质的沟内。随后这些细胞表现为在它们表面形成的复合体的供称作辅助性T淋巴细胞的白血细胞细读。
身体抵抗力下降
每个辅助性细胞都带有能识别单个显示的肽即表位受体。如果它遇到了巨噬细胞或相似细胞上的适当的表位,就与肽结合,分裂出和分泌出小的蛋白质。这种蛋白质帮助激活和促进复制免疫系统的其它静止成分——特别是胞毒性(或杀伤性)T淋巴细胞和B淋巴细胞。
在适当的环境下,杀伤性T细胞直接攻击受感染的细胞。受感染的细胞如象巨噬细胞那样分解某些病毒粒子,结合某些带HLA分子的片断,并在细胞表面上表现为复合体。如果一种胞毒性T淋巴细胞通 过它的受体识别罹病细胞上的一个表位,它将在产生更多的病毒粒子之前与表位结合并破坏细胞。激活的B淋巴细胞分泌通能识别病毒表面上特异肽的抗体。这种抗体标记尚未在细胞内被隔离的游离病毒粒 子,以便进行破坏。
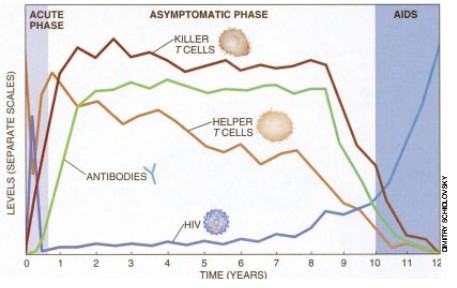
据信所有这些应答都参与对 HIV的防御。在HIV感染的最初阶段,病毒定殖于辅助性T细胞和巨噬细胞中。一段时间内,它也能自由复制。当病毒数量增长时,辅助性细胞就下降,巨噬细胞也死亡,但对它们的影响研究极少。当成千上万的新病毒粒子从细胞膜中伸出时,被感染的T细胞就死亡。可是,很快地胞毒性T淋巴细胞和B淋巴细胞就建立了很强的防御力量,并杀死许多感染病毒的细胞和病毒粒子。这些效应限制了病毒生长,并给身体一个机会,使暂时恢复辅助性细胞的供应以达到几乎正常的浓度。然而,病毒仍能继续存活下去。在最初阶段(它可能历时数周),约30%受感染的病人表现出某些症状,通常可能为疹和淋巴腺肿大并伴有发烧。可是,甚至这些人一般也继续进入长期的无症状阶段。
在整个第二阶段,免疫系统仍继续很好地发挥功能,可测量的病毒纯浓度相对保持较低。但是,与并行的辅助性细胞群体下降相比,病毒水平逐渐升高。累积的证据表明,辅助性细胞的损失掉是因为病毒和胞毒性T细胞破坏它们,而不是因为人体产生新辅助性细胞的功能受到伤害。这是一个可悲的讽刺,控制HIV感染所需的杀伤性细胞也损害需要有效地发挥作用的辅助性T细胞。
当辅助性细胞计数降至每毫升血200个(健康人为每毫升1000个)时,一般就说明患者穿越到了艾滋病的界限。在这个阶段,病毒水平急剧升高,而免疫活性的测定值降至零。免疫能力的丧失,使得一般较温和的微生物(特别是原生动物和真菌)在艾滋病患者中引起威胁生命的疾病。一旦发展成艾滋病,患者很难成活两年以上。
面对HIV持续攻击而保持良好的免疫应答提出了一个问题:在大多数(即使不是全部)情况下,为什么免疫系统不能完全消灭HIV。几年前,HIV的各种特征导致我们中的一位(Nowak)和牛津大学动物系他的同亊认为,其答案在于病毒在人体内进行演化的能力。
演化理论预示的麻烦
演化理论认为,有时单个有机体的遗传物质的机会突变产生有利于该有机体生存的特性。即是受影响的个体比它的同类有更强的能力去克服生存的障碍,而且也有更强的能力去大量的繁殖。随着时间的推移,具有相同特性的后代战胜了其它的成员,成为群体中最多的——至少直到另一个个体获得更强的适应性性状或直到环境条件变得有利于不同的特征之前是如此。然后环境施加的压力决定选择哪些特性在群体中传布。
当Nowak和他的合作者考虑到HIV的寿命时,似乎很明显,微生物特别能很好地适应于从它所面临的任何压力(即寄主的免疫系统所施加的压力)演化下去。例如,它的遗传组成不断变化;高突变率增加了某些遗传变化将带来有利性状的可能性。这种很大的遗传变异性来自病毒酶反转录酶的特性。在细胞内,HIV用反转录酶将它的基因组拷贝人双链DNA中。这种DNA被插入到寄主的染色体中,在那里它指令生产更多的病毒RNA和病毒蛋白。这些成分又将它们组装到能从细胞中逃出的病毒粒子中。病毒在此过程中很容易突变,因为反转录酶是相当易出错的。据估计,每次该酶制成DNA在一个位点上新的DNA—般不同于先前产生的DNA。这种模式使 HIV成为已知的最易变的病毒。HIV的高复制率进一步增加会产生一种对病毒有用突变的可能性。为了正确评价HIV增殖的程度,让我们考察一下位于伯明翰的阿拉巴马大学的George M. Shaw和纽约市艾伦戴蒙德艾滋病研究中心David D. Ho领导的研究小组今年初宣布的研究结果吧。该研究小组报告,每天在受感染的患者体内至少会产生10亿个新的病毒粒子。他们发现,在缺乏免疫活性的情况下,病毒群体平均每两天翻一番。这些数字意味在感染后10年内,体内存在的病毒粒子已从原病毒推进了几千代。因此在10年内,病毒能够进行的遗传变化与人类在数百万年的过程中所经历的遗传变化相当。
疾病的发展方式
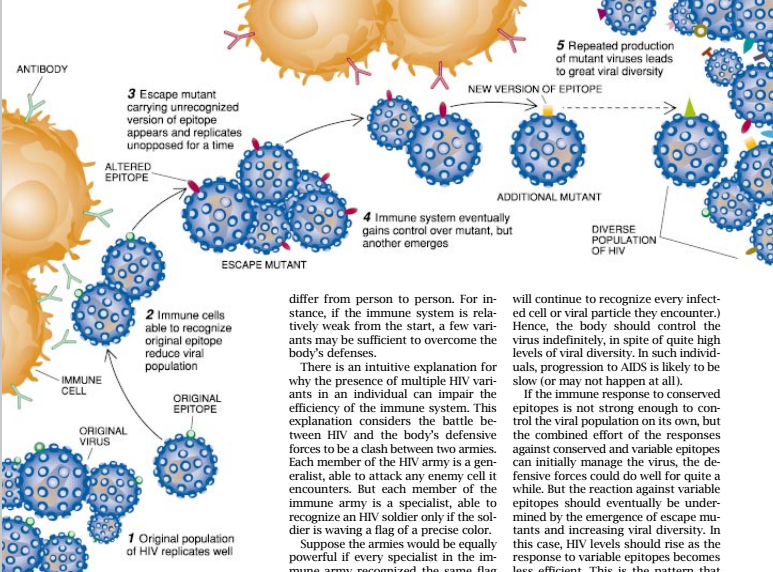
由于在心底里认识到HIV有很强的演化能力,Nowak和他的同事设想了一种方式,他们认为可以用它来该病毒怎样抵抗住完全被消灭。因而在一段较长时间之后通常才引起艾滋病。他们提出假设,病毒基因不断地突变会导致连续产生能够在某种上逃避在任何给定时间都在起作用的免疫防御的病毒变异株。当基因突变导致被免疫系统所识别的病毒肽(即表位)的结构改变时,这类变异株就会出现。这种改变常对免疫活性没有什么影响,但有时它们能引起肽变成看不见的体内的防御系统。这种改变了的病毒粒子带有较少可识别的肽,此后变为更难于被免疫系统探查到。
这一假说提出,能够减少表位说别的突变,至少在免疫系统发现这改变了的肽并与其反应之前将有利于病毒变异株的生存。这种响应将暂时减少病毒的负荷,但同时其它的“可逃避突变体”将开始爆发,而且这种循环将继续,以防止感染完全消除。
这种方案极难单独用临床试验来证实,主要是因为病毒和免疫系统之间的非线性相互作用是不可能详细进行监测的。因此,Nowak转向使用计算机模拟,其中一个最初为均一的病毒群体随免疫压力的响应而演化。他推断,如果这数学模式得出HIV的已知进展模式,他就可断定这种演化方式有某种价值。
能反映Nowak和他的同事认识到的特性形成之模式核心的方程,在HIV感染的进程中是重要的:病毒损伤免疫功能主要是由于引起辅助性T划胞的死亡和较高的病毒水平引起见多的T细胞死亡。病毒也不断产生可逃避的突变株,它在某种程度上可避免目前的免疫攻击,同时这种突变株在病毒群体中传布。不久,免疫系统就有效地发现突变株,引起突变株体缩小。这种模式不能区别两种免疫应答:即特别容易进行突变的表位的免疫应答和识别保存表位的免疫应答(后一种表位在体内的每种病毒粒子上表现出不变的形式,因为病毒不能承受这种表位的缺失和改变)。
这种模拟解决重现HIV感染和病毒水平在体内最终急剧升高之间典型地长期推迟。它还能解释为什么逃避和抑制的循环不能无限制地进行下去,却以不能控制病毒复制而告终,这几乎完全失去了辅助性T细胞群体,同时艾滋病发着。
这个模式特别指出,免疫系统往往能同时展开对几种病毒和变异株的强有力的防御。但通常是在许多年之后,在有太多的HIV变异株时才会发生这种情况。当超过了这一阈限,免疫系统即无力控制病毒。这种由我们称之为突破点的“多样性阈限”因人而异。例如,如果开始时免疫系统相对较弱,那么少数变异株就足可以攻破体内的防御系统。
对于为什么在个体内存在多个HIV变异株就能损伤免疫系统的效能有一个直觉的解释。这种解释认为,HIV和体内防御力量之间的战斗是两军之间的冲突。HIV军中的每一个成员都是多面手,能够攻克它所进到的任何敌方细胞。但免疫军中的每个成员却是专家,只有当 HIV的士兵在挥舞准确颜色的旗帜时才能识别这个士兵。
假定两军同样强大,即免疫军中的每个专家都能识别同样的旗帜,而每个HIV士兵都执有那种旗帜。现在假定HIV军由三个集团组成,每个集团都执有不同的旗帜;在响应中,免疫专家也分为三个集团, 每个集团识别不同的旗帜。在这些条件下,免疫军将显著失利。任何给定的免疫专家将只能识别和攻击它所遇到的三个敌军士兵中的一个——执有正确旗帜中的那一个。其间HIV 士兵将继续收拾它们所遇到的每一个专家,并最终赢得学场战争的胜利。
预测病程
这个模式除给我们多样性阈限的概念之外,还对为什么有些患者比另一些患者更快地发展为艾滋病提供了可能的解释。如果对保存表位的初始免疫应答很强烈,那么对 HIV的防御性进攻的效能将不会受到其它表位突变体太大的破坏。(免疫系统的许多其它活跃成员将继续识别它们所遇到的每个受感染的细胞或病毒粒子。)因此,尽管病毒多样性的水平很高,但身体应能够长 时期地控制病毒。在这种个体内,艾滋病的发展可能是很慢的(或完全不会发生)。
如果对保存表位的免疫应答强度不足以控制自己的病毒群体,但对保存的表位和变异的表位的应答结合力最初能控制病毒,在相当长的时期内防御力量能很好发挥。可是对变异表位的应答最终因出现可逃避的突变体和病毒多样性的增多而破坏。在这种情况下,当对变异表位的应答变为几乎无效率时,HIV 的水平将升高。这是很明显地发生于大多数患者身上的模式。
如果对保存的表位和变异体表位的结合免疫应答在开始时太弱,不能控制HIV复制,那么艾滋病就能够迅速发展。在这种情况下,原病毒粒子将增殖而不会遇到多大的阻力,因此病毒在产生能逃避免疫搜 索的突变体方面几乎不会有什么压力。这种患者即使在无显著的病毒多样性对也会发展成艾滋病。
这种模拟还提供对HIV各个阶段病毒群体可能特性的了解。在最初的日子里,免疫系统尚未最大激活,复制最快的病毒变异株最丰富。因此,即使患都同时被几种变异株感染,在短时间之后,体内的大多数病毒可能都来自生长得最快的变异株。因此我们预计,在发病的急性阶段,遗传多样性极少。
在免疫系统变得更活跃之后,HIV的生存就更复杂化了。它不再十分自由地复制;病毒也必须是能够避开免疫攻击的。当我们预计将产生选择压力吋,正是免疫力量识别的表位增加多样性之时。一旦防御系统已崩溃而且病毒存活不再有障碍时,变异的压力也就消除。此后,对艾滋病患者,我们将再度预先选择最快生长的变异株,病毒多样性减少。
涉及到少数患者的长期研究已证实模型的某些预测。几位研究者(包括爱丁堡大学的Andrew J. Leigh、阿姆斯特丹大学的jaap Goudsmit、华盛顿大学的James I. Mullins和西北大学医学院的Steven M. Wolinsky)所作的这些研究追踪了所谓V3蛋白质片断在 HIV外膜中几年内的演化。V3是抗体的主要目标,而且是高度可变的。根据计算机模拟预计,在患者受感染后几周内获得的病毒试样都同样在V3区域。但是在随后的几年,该区域分化。
集中于杀伤性细胞
原有的数学模型将免疫系统作为一个整体对待,对不同细胞类型的激活之间不作区别。因为杀伤性T淋巴细胞似乎对HIV施加巨大的免疫压力,我们和我们的合作者最近都设计了特别考察这些细胞行为的模型。这些更新的模型告诉我们更多的关于HIV多样化的能力的方式,该方式能够逃避免疫系统的防御能力。
1994年初,我们之中的一位(McMichael)被他和几位合作者追踪最初无症状患者的胞毒性T细胞对HIV的应答之研究结果弄得很困惑之后。我们开始研究这些模拟。这些研究追踪患者约5年之久,部分是为了评价不同HLA分子以对患者与病毒战斗能力的影响。
HLA分子在防御应答中起着关键性的作用,因为它们决定着什么样的病毒肽将出现在细胞上和它们怎样有效地显示其优点。任何两位患者在他们所具有的HLA分子的精确混合物中都很可能不相同。因此,在它们细胞表现的肽表位和HLA-肽单位引起免疫系统注意的能力方面也会不同。感染HIV的大多数患者似乎都只能识别由病毒蛋白产生的许多潜在表位中的少数几个,通常是在1与10之间。
临床研究考察了胞毒性T细胞对被称作gag的内部HIV蛋白的各种表位的应答。对于这种表现,有三位患者使用HLA变异体B27,两位患者使用HLA-B8。在B27患者中,胞毒性T细胞应答是针对gag蛋白的单个片断,这种蛋白在研究过程中发生不明显的变异。在B8患者中,杀伤性T细胞活性是针对gag中一组三个其它的片断。所有三个表 位在研究期间都大量产生突变体,而且许多突变体肽都逃避了寄主的胞毒性细胞的识别。也已弄清楚,针对着三个表位应答的相对强度明显地有波动。
这些研究是首次证实在人体内存在可逃避杀伤性T细胞的突发病毒。但它们也提出了一些困惑的问题,特别是T细胞对几个表位的应答强度为什么波动如此大?在大多数其它病毒感染中,通常针对一个或几个表位的应答要稳定得多。
杀伤性细胞为什么走向迷途
我们的研究小组合作研究作出细胞毒性T细胞对HIV应答的计算机模型就是为了部分回答这个问题。这个程序假定,感染细胞中病毒粒子的分解会引起胞毒性T性细胞识别的许多表位显示。这个模型还假定,大多数表位或许能够突变,因此产生在某些它们的表位中有变化的病毒变异株。
这些模型引人表位的随机突变,然后追踪每个新病毒变异株的生长以及针对每个表位的胞毒性T细胞的丰度。识别给定表位的T细胞丰度(以及这些群体由此而产生的杀伤力)是被迫依赖于带有那种表位的病毒粒子数和肽的刺激能力。(一些表位比另一些表位能诱发更多的T细胞复制。)
至少可以这样说,多重表位模型的结果是复杂的。可是,实质上免疫系统总效力在规定时间之外下降,这种下降起因于产生B8型HLA分子的两个患者中所看到的免疫活性许多相同种类的波动。这种波动似乎是由杀伤性T细胞群体之间一种竞争产生的。
我们的计算表明,在体内杀伤性T细胞(识别一个表位的群体)的一个克隆实质上与所有其它的克隆竞争优势。当涉及到许多克隆的杀伤性细胞最初的应答发生时,病毒群体很小,因此降低了T细胞接收到的刺激信号数量。最后,只有识别大多数刺激表位的T细胞克隆保持活力,甚至T细胞应答可能被单一的克隆所支配。
这种过程可能是有益的,同时如果微生物不改变,它可能消灭该病毒。另一方面,如果向优势应答提供燃料的表位突变,相应的T细胞克隆不可能识别这个突变体。然后 带有这种肽的病毒粒子实际上可能不太引人注意地增殖。有时免疫系统将赶上这变节的一群病毒,并建立将目标指向表位的新变体的防御系统。但在另一些时候,防御系统可将它的注意力转向不同的和原来极少刺激的表位。这种改变可重复多次,产生一个非常复杂的模式,其中T细胞克隆的相对丰度不断地波动。因此,出现一种不可识别的表位形式至少在两方面会引起麻烦。除直接减少对改变了的病毒变异株的攻击力外,它还能引起免疫系统改变它对极少刺激表位的效力。
从我们新近模拟所形成的球面照片是关于表位多样性引起免疫应答的波动,并转向越来越弱的表位的照片。这种转向引起较高水平的HIV,导致更快地杀伤辅助性细胞和巨噬细胞,并降低总病毒群体的控制。换句话说,病毒多样性似乎促使疾病发展。这种多重表位模拟也 可用于抗体应答。
对治疗的设想
对于不熟悉这些研究结果的人可能有理由怀疑,对许多不同表位应答的患者将能较好地控制病毒群体,因为未被免疫细胞的一种克隆注意的微生物粒子或许能被另一种克隆所注意。然而我们的模型预测, 在HIV的情况下,对许多不同表位的应答可能是一个坏的信号——是重要的表位可能已进行了不能识别的突变的象征。这种模拟意味着,免疫防御系统可稳定地识别一种或少 数几种表位的患者,或许对病毒的控制优于对许多数量的表位有响应的患者。这种观点得到早先描述的HLA研究中一个有趣的发现所支持。这两种患者表现波动的T细胞应答,向艾滋病的发展快于对单一表位有一致响应的患者,但本研究涉及到的患者太少,不能作出肯定的结论。
如果这个模型精确地反应了HIV病的病程,那么这些研究结果对开发疫亩(预防或治疗)和化疗有用。在开发疫苗的情况下,它或许会对刺激免疫活性去抗击个体的各种 HIV表位得到事与愿违的结果。总之,这种刺激或许在免疫力量中诱发出了一种不理想的竞争。可以说,它可更好地促进对单一保存的表位的应答,即使表位不是一般最容易识别的也是如此。这种应答能够理想地引起对HIV的持久的控制应答。当然,其诀窍应是鉴别保存的表位,并找到传递它们的最佳途径。
另一个惊人的含义是关于在感染的各个阶段病毒快速地和连续地复制。这一认识使许多医生得出结论:在病毒有机会扩展得太多之前, 较早提供能够制止病毒复制的化学剂或许是最有效的。综合治疗也可能比单一的药物更有效,因为即使病毒产生抗一种药物的突变群体,但其它的药物仍然能够继续有效。通过减慢复制的速率,应能降低突变株产生的速度,从而限制病毒的多样性。我们的模型进一步表明,以此方法来降低病毒水平和减 少多样性会有助于可遏到病毒的自然免疫系统。
HIV动力学的主要观点
收集的临床和数学模型研究的结果表明,HIV除在受感染的患者中大量复制外,它还重复地突变,因而病毒群体产生巨大的多样性。这些特性使病毒对个体感染过程中随所遇到的威胁而演化。在某种程度上出现可逃避免疫攻击的突变株,并在免疫系统聚集力量消除它们之前占优势——但同时,新的可逃避的突变株开始繁殖。因此势力重复地从 病毒移回免疫系统一边,而在一些时候则又返转过来。
可是,反过来却不能无止境地进行f明显地由于病毒多样性的演化逐渐向病毒平衡倾斜。多样性有利于微生物,部分是因为变异能力使患者的免疫系统失常,使之变得几乎无效,因而病毒群体增长,并杀死更多数量的辅助性细胞。
当然,杀伤辅助细胞会损伤杀伤性T细胞和B细胞的功能,后两种细胞只有当受辅助细胞释放的蛋白质刺激时才反应强烈。当这两类细胞变得更加低效时,一个潜在的致死螺旋形接着发生,其中病毒水平进一步升高,更多的辅助性T细胞被杀死,免疫系统总的应答降低。
因此突变株的形成刺激免疫系统的效能不断地下降。在某一点,多样性的广泛使免疫系统难于对付,HIV完全逃避了控制。当病毒负荷增大时,辅助性细胞被杀死的速率加快,从而超过了艾滋病的阈限,最后免疫系统崩溃。简言之,演化的方式似乎能够通过很长的路程。可解释为什么HIV感染一般发展很慢,但最后总是或几乎总是破坏免疫系统。 (参考文献略)
请 登录 发表评论