一次意外事故中,海伦踩刹车时不慎扭伤左脚脚踝。据她回忆,当时似乎只是轻微扭伤,但疼痛一直没有消退,反而越来越严重。最后,即便是床单轻轻拂过的轻微触碰,都会使左脚产生剧烈疼痛。“我已疼得说不出话了,内心却在大声哭喊,”这位年轻的英国女士在一份网络杂志上写道,而这种神秘病痛竟折磨了她三年之久。
海伦遭遇的是慢性痛,与人们时常经历的急性痛有本质区别。急性痛是人体最具警示意义的强烈感觉,能使我们终止自我伤害。这类疼痛又叫病理性疼痛,通常由外部刺激导致,比如组织受损,产生痛感信号,经由神经系统传送至大脑,让我们感到疼痛。不过设想一下,如果我们受伤,肠道扭曲般的剧痛永不消失,甚至伤口痊愈后也是如此,又或者日常感觉全都变成极度疼痛,我们将面临怎样的灾难?“我根本不敢淋浴……水滴就像一把把匕首,”海伦回忆说,“汽车里的轻微震动、有人从地板上走过、人们的说话甚至微风吹过……都会给我带来难以忍受的疼痛。普通镇痛药,甚至吗啡都不起作用。我的大脑就像是在捉弄我。”
海伦确实不走运。困扰她的慢性痛源于痛感回路功能失常,以致持续触发错误的警报信号。这种疼痛在专业上又叫做神经病理性疼痛(neuropathic pain),是神经自身行为异常的一种表现。当错误信号抵达大脑,引起的剧烈疼痛就像我们真正受到足以威胁生命的创伤一样,而且疼痛感挥之不去,连医生也束手无策。
科学家最近才发现,为什么传统镇痛药对神经病理性疼痛几无作用:这些药物的作用目标都是神经元,但慢性痛的根源不在神经元,而是由大脑和脊髓中的神经胶质细胞(glia) 功能失常导致。这些细胞的“本职工作”是调节神经元功能并提供养分,它们为何会功能失衡,甚至破坏神经元的功能?在寻找答案的过程中,科学家已发现了一些可能治疗慢性痛的新方法。另外,如果长期服用传统镇痛药,一些人便会对此成瘾,这是医学界的一大难题,而上述研究也让消除镇痛药的成瘾副作用成为可能。
过度敏感的神经元
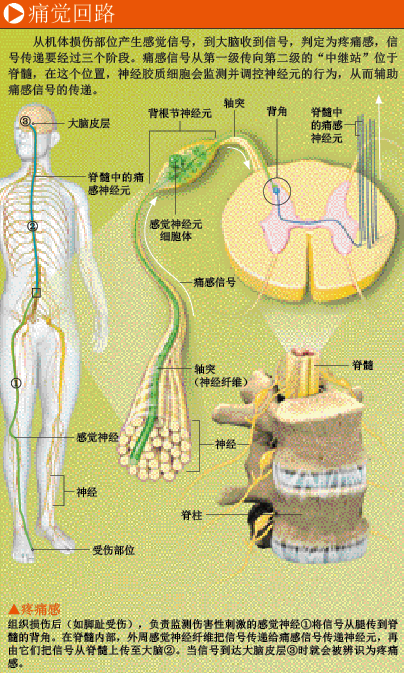
创伤愈合后,疼痛感为什么会持续存在?要弄清楚这个问题,我们首先需要了解疼痛产生的生理机制。受伤时,虽然是大脑让我们感到疼痛,但产生痛感的神经元却不在这里,而是在脊髓中,负责搜集人体各部位传来的感觉信号。背根节(dorsal root ganglion,DRG)神经元是三级痛觉传导通路中的第一级,它的细胞体犹如一串串葡萄,塞在相邻脊椎骨的缝隙中,整体上就像是双排扣上衣上的两排纽扣,从尾椎一直排列到头骨。就像一个人伸开双臂一样,每个背根节神经元也会伸出两个轴突分支:一个向外延伸,用于探测人体远端的细小区域;另一个伸入脊髓,与其他神经元建立联系,把痛感信号传递至第二级痛觉传导通路(由一系列脊髓神经元构成)。接收到背根节神经元传来的信号后,脊髓中的痛感传递神经元立即把信号传至痛觉传导通路的“中继站”——丘脑,最终抵达大脑皮层。来自人体左侧的痛感信号会通过脊髓,交叉传至右侧大脑,来自右侧的信号则传往左侧大脑。
阻断痛觉传导通路的任何环节,都可以抑制急性痛的产生。牙科医生拔牙时常用的普鲁卡因(novocain)等局部麻醉药,能麻痹注射区域周围的轴突末梢,阻止神经元放电。孕妇分娩时,医生常使用“脊髓阻滞术”(spinal block),在背根节神经元的轴突与脊髓神经元建立联系的地方,阻断痛感信号向第二级痛觉传导通路传递,从而消除疼痛,让孕妇保持清醒,配合医生,顺利生下孩子。在脊柱周围注射吗啡(morphine),也能降低脊髓神经元传递痛感信号的强度,而不影响其他感觉的灵敏度。相反,用于大型手术的全身麻醉药,会干扰整个大脑皮层的信息处理过程,使患者无法感知大脑外部神经通路传来的任何信息。
人体内的天然镇痛物质也能作用于痛觉传导通路。战斗中,身受重伤的士兵可能感觉不到伤口的存在,因为在肾上腺素的作用下,大脑皮层会忽略痛感信号,让士兵更好地处理极端情绪,应对危险的战争环境。自然分娩时,孕妇的身体会分泌一种叫做内啡肽(endorphin)的蛋白质,抑制痛感信号在脊髓中的传递。
通过调节痛觉传导通路中的信号传递过程,激素、情绪状态等多种因素都可以显著改变人体对疼痛的感知。很多生理机制和生物分子也能控制离子通道的开合状态,影响神经元内各种分子的浓度,以此来调节神经元对痛感信号的敏感度。当人体受到创伤时,上述各种因素会放松对神经元放电的控制,促进神经元传递痛感信号。
不过,这种无约束状态可能持续很久,导致背根节神经元过度敏感,在没有外界刺激的情况下也发放痛感信号,这就是神经病理性疼痛产生的主要原因。神经敏感性增强,还会引起发麻、灼热感、瘙痒、感觉异常,甚至可能把我们对轻微触碰或者温度变化的感觉放大到疼痛的程度(这种现象被称为allodynia,即异常痛觉)——就像海伦淋浴时,会感到刀刺一般疼痛。
人体受伤后,痛觉传导通路中的神经元为何会过度敏感?长期以来,为了回答这一问题,科学家重点研究“神经元出了哪些故障”,虽然也找到了一些线索,却始终无法给出明确答案。我和很多同事的研究证明,痛感神经元在传递痛感信号时,神经元内某些基因的活性会发生改变,而这些基因编码的离子通道或其他物质可以增强神经元的敏感性。组织受损后,活跃的背根节神经元会使痛感神经元变得敏感,神经病理性疼痛可能随之而来。然而,我们和其他实验室的研究都显示,并非只有神经元会对损伤作出反应,释放促进神经敏感化的物质。
在脊髓和大脑中,神经胶质细胞的数量远超神经元。它们与神经元不同,本身不能发放电脉冲,但一些重要特性会影响神经元放电。神经胶质细胞能维持神经元周围化学环境的稳定:除了为神经元提供能量,还能回收神经元向邻近神经元放电时释放的神经递质。有时,神经胶质细胞甚至能调配神经递质,以增强或调节神经信号的传递。如果神经元受损,神经胶质细胞不仅会释放生长因子,帮助神经元维持生命,促进康复,还会释放化学物质,召集免疫细胞,对抗感染,启动神经元复原的生化过程。然而最近的研究表明,除了上述作用,神经胶质细胞还可以使神经元的敏感状态持续下去。
“双面”神经胶质细胞
100多年前,科学家就已知道神经胶质细胞会对人体损伤作出反应。1894年,德国科学家弗朗兹·尼斯(Franz Nissl)发现,神经受损后,脊髓或大脑中与神经相连区域上的神经胶质细胞会发生显著变化:小胶质细胞(microglia)增多,星形胶质细胞(astrocyte,因星形细胞体得名)变得“结实”而充盈,内部出现很多粗状的微管束,以强化细胞骨架。
在科学家看来,神经胶质细胞的这些反应是为了促进神经修复,但它们如何做到这一点却不得而知。如果受伤部位与脊髓中的痛觉传导通路相隔甚远(比如扭伤了脚踝),那么星形胶质细胞的反应必定不是直接针对受伤部位,而是背根节神经元与脊髓神经元交接处神经信号的变化——这就暗示,星形胶质细胞与小胶质细胞一直在监测痛感神经元的生理特性。
在过去20多年里,科学家发现神经胶质细胞能用多种生理机制监测神经元的电活动,比如利用离子通道检测神经元放电时释放的钾离子(或其他离子)、利用细胞表面受体感知神经元通过突触相互“交流”时释放的神经递质。谷氨酸、ATP和一氧化氮是神经胶质细胞可检测到的重要神经递质,但除了它们,还有很多神经递质也在胶质细胞的检测范围内。正是凭借这些化学感受器,神经胶质细胞能监测大脑和全身神经回路中的电活动,并对不断变化的体内环境作出各种反应。
由于认识到神经胶质细胞能对神经活动产生广泛影响,科学家立即将注意力转移到“痛感信号中转站”,研究该处神经胶质细胞的可疑行为。既然神经胶质细胞会持续监测痛感信号的传递,它们是否会对传递过程产生影响?在尼斯观察到神经胶质细胞会对神经损伤作出反应的100多年后,一个简单实验首次对这个疑问作出了回答。
1994年,美国艾奥瓦大学的施蒂芬·T·梅勒(Stephen T. Meller)及其同事给大鼠注射了一种毒素,选择性地杀死星形胶质细胞,然后检测大鼠对疼痛的敏感性是否有所降低。结果,大鼠对疼痛的敏感性并未降低,说明星形胶质细胞在急性痛的信号传递中没有明显作用。
接着,科学家又为大鼠注射神经刺激剂,逐步引发慢性痛——类似于遭遇汽车事故,脚踝神经受到刺激的很长一段时间后,发生在海伦身上的神经生理过程。然后,他们仍为大鼠注射毒素,杀死星形胶质细胞,结果显著抑制了慢性痛的产生。这说明神经受损后,星形胶质细胞以某种方式引发了慢性痛。科学家进一步研究,揭示了其中的原理。
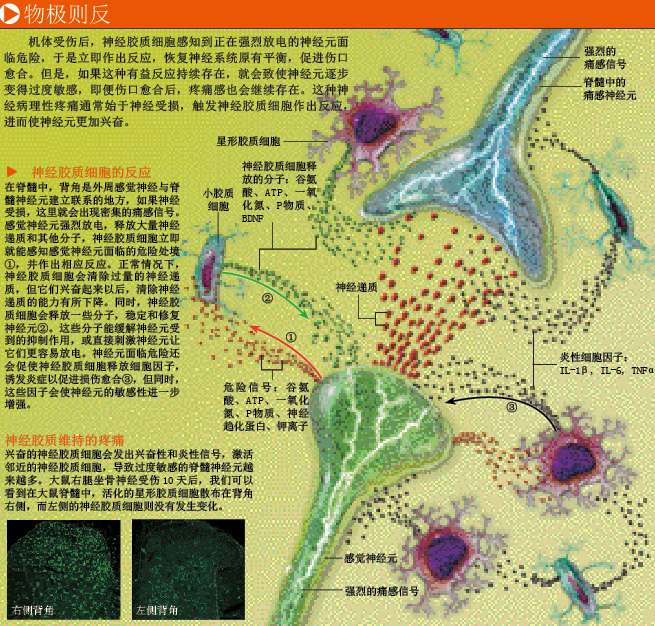
神经胶质细胞会释放生长因子、神经递质等多种分子,增强背根节和脊髓神经元的敏感性,让它们向大脑高效传递痛感信号。科学家已经知道,神经胶质细胞会把神经元快速放电及与此相关的神经变化当作神经元面临危险的标志,一旦发现这种标志,它们就会立即作出反应:释放一些致敏分子(sensitizing molecule),促进神经信号传递,减轻神经元受到的压力,并启动神经元的修复过程。
当神经元受损或面临危险时,神经胶质细胞还会释放一类重要分子——细胞因子(cytokine)。这是一种强力化学信号,就像航标灯一样指引着免疫细胞到达损伤部位。如果一块微小的异物碎片刺入指尖,人体内的一个细胞想要找到这块碎片无异于大海捞针,此时细胞因子就显得格外重要。被碎片损伤的细胞释放大量细胞因子,诱导血液和淋巴中的免疫细胞涌向指尖,对抗感染,启动修复过程。细胞因子还能引起组织和血管的改变,利于免疫细胞发挥功能,促进伤口愈合,但也会使损伤部位变得红肿。这种由细胞因子信号传导引发的一系列生理过程叫做炎症反应。
一块碎片就让我们看出,细胞因子能以多高的效率诱使免疫细胞向伤口移动,但让人印象更为深刻的,恐怕是这块微小碎片引起的剧烈疼痛。相对于微不足道的组织损伤,这种疼痛似乎很不成比例。尽管周围的皮肤细胞并未受损,但碎片附近的皮肤很快就会肿胀起来,对疼痛非常敏感。伤口周围的皮肤之所以会对疼痛敏感,是因为除了引起炎症反应以外,细胞因子还有一个作用:极大地增强痛感神经纤维的敏感性。受伤部位附近的疼痛感受器过度敏感,能让我们尽量不触碰该部位,利于伤口愈合,这是机体的一种保护机制。
神经系统中,分泌细胞因子的通常不是神经元,而是神经胶质细胞。正如细胞因子使指尖伤口周围的神经末梢变得过度敏感一样,在脊髓中,高强度的痛感信号也会促使神经胶质细胞释放细胞因子,这些分子随即向相邻神经纤维扩散,使神经纤维处于过度敏感状态。结果,过度敏感的神经元无规则放电,致使神经胶质细胞进入应急状态,释放出更多致敏因子和细胞因子来缓解神经元受到的压力,形成了一个循环,延长了整个过程的持续时间。这种状况一旦发生,脊髓中并未受损的神经纤维也会发出痛感信号。
组织受损时,神经胶质细胞的起始反应确实有利于组织修复,但如果反应过于强烈,或持续时间过长,慢性痛就会不可避免地发生。一些研究小组已经证实,脊髓中的这个循环过程能使神经胶质细胞持续释放致敏因子和炎症信号,进而引起神经病理性疼痛。目前,很多科学家正在试用各种方法,以逆转这一循环过程。在麻醉领域,这些研究已催生了一些新方法,能使麻醉剂更高效地消除急性痛。
消除慢性痛
过去,所有治疗慢性痛的方法都是直接抑制神经元的活动,但如果不能终止神经胶质细胞对神经元的刺激,慢性痛根本得不到缓解。幸运的是,科学家已经知道,在致使神经元敏感化的恶性循环中,神经胶质细胞到底扮演了怎样的角色。这些认识也催生了一些新方法,让科学家可以直接针对功能异常的神经胶质细胞,从根源上消除神经病理性疼痛。目前,正处于研究中、通过调控神经胶质细胞来治疗神经病理性疼痛的方法主要有3种:抑制神经胶质细胞的活动、阻断炎症触发分子及相关的信号传导、发出消炎信号。
美国达特茅斯医学院的乔伊斯·A·迪里奥(Joyce A. DeLeo)和同事在动物实验中发现,一种名为丙戊茶碱(propentofylline)的化学物质能够抑制星形胶质细胞的活动,从而缓解慢性痛。抗生素米诺环素(minocycline)既可以阻止神经元和神经胶质细胞分泌炎性细胞因子和一氧化氮,也能减少向创伤部位迁移的小胶质细胞数量,说明该药物能阻止神经胶质细胞过度活化。
在另一项研究中,科学家把注意力集中在Toll样受体(Toll-like receptor, TLR)上。它是神经胶质细胞表面的一种蛋白质,可以识别神经元面临危险时释放的特定标志物,促使神经胶质细胞释放细胞因子。美国科罗拉多大学博尔德分校的琳达·R·沃金斯(Linda R. Watkins)和同事发现,如果用化学物质阻断动物脊髓中神经胶质细胞上的一种Toll样受体——TLR-4,就可以消除坐骨神经受损引起的神经病理性疼痛。有趣的是,纳络酮(naloxone)本来用于削弱人们对阿片类药物的成瘾依赖,研究却发现这种药物也能阻止神经胶质细胞对TLR-4活化作出响应。沃金斯已证明,纳络酮可以消除大鼠身上已经全面发作的神经病理性疼痛。
另一种很有效的镇痛药是古老的大麻,即使其他镇痛药都无效时,它也能正常发挥镇痛作用,目前一些国家和地区已允许大麻用于医疗。在大麻植株中,一些化学物质与大脑天然产生的大麻素(cannabinoid)很相似,可激活神经元表面的某些受体,调节神经信号的传递。
大脑和神经系统含有两种大麻素受体:大麻素受体1(CB1)和大麻素受体2(CB2),它们的功能各不相同。激活CB2可以缓解疼痛,激活CB1却会产生类似吸食大麻的效果。值得注意的是,CB2并非位于神经元上,而是在神经胶质细胞表面。大麻素与小胶质细胞上的CB2受体结合,会抑制该细胞发出炎性信号。最近的研究发现,随着慢性痛发作,小胶质细胞上的CB2受体数量将会增加,这是细胞正在努力捕获更多大麻素分子以缓解疼痛的一种征兆。目前,制药公司都在开发能作用于CB2受体的药物,以达到单纯镇痛又不让病人精神亢奋的目的。
动物实验证实,利用阿那白滞素(anakinra,商品名为Kineret)、依那西普(etan-ercept,商品名为Enbrel)等消炎药,阻断会引发炎症反应的细胞因子,也能缓解神经病理性疼痛。一些研究小组发现,给动物注射IL-10(白细胞介素)、IL-2等具有消炎作用的细胞因子,不仅能阻断炎性信号,还可抑制神经病理性疼痛的产生。目前,喷托维林(pentoxyfilline)和AV411两种现有药物都可以刺激细胞分泌IL-10,抑制炎症反应。还有一些研究小组将编码IL-10和IL-2的基因转入动物肌肉或脊髓,这种方法能在4周内抑制神经病理性疼痛的产生。
上述部分药物已进入人体试验阶段(参见第43页图表)。在日本, AV411已经作为消炎药,用于治疗中风。澳大利亚的一项临床试验表明,疼痛患者在使用AV411后会主动地要求减少吗啡服用量,这表明AV411确实具有镇痛作用。不过,AV411的镇痛机制可能不只是缓解炎症导致的疼痛,这使神经胶质细胞与疼痛间的复杂关系更加引人注目。
成瘾:镇痛的另一面
吗啡是已知最有效的镇痛药物之一,但由于极易使人上瘾,医生在大多数情况下,甚至在治疗晚期癌症患者时,对吗啡的使用都慎之又慎。与海洛因、鸦片和现代麻醉剂(如羟考酮,OxyContin)一样,吗啡也是通过阻碍脊髓神经元间的信息交流、削弱痛感信号的传递,从而发挥镇痛作用的。
遗憾的是,吗啡和其他麻醉药品的镇痛作用会随着使用次数增多而迅速减弱——也就是说,人体对这些药物会产生耐受性。为了达到初次使用时的镇痛效果,给药剂量必须增大,用药次数也必须增加。慢性痛患者还可能对药物上瘾。医生则担心,给患者开大量的麻醉剂可能被怀疑涉嫌毒品交易,因此只能限制患者的用药剂量,但这样又不能有效缓解疼痛。一些患者会通过非法手段来获取镇痛药,以便缓解难以忍受的病痛,甚至还有少数患者选择自杀来摆脱痛苦。最近,一些科学家在研究镇痛、神经胶质细胞和药物成瘾三方面的关系时证实,人体对吗啡和海洛因产生耐受性与神经胶质细胞有着密切关系。
怀疑神经胶质细胞可能与麻醉剂耐受有关的想法,最初产生于科学家对麻醉剂成瘾患者的观察:与那些通过“冻火鸡法”(cold turkey)戒毒的海洛因成瘾者相似,对麻醉剂产生依赖性的患者一旦停药,就会出现以疼痛为特征的典型戒断反应。这些患者会变得极度敏感,哪怕是正常的声音和光照都会让他们感到疼痛难忍。这些症状与神经病理性疼痛患者表现出的感觉过敏十分相似,说明两类症状可能有共同的诱因。
2001年,中国科学院上海生理学研究所的宋萍和赵志奇的研究,验证了人体对吗啡的耐受性与神经胶质细胞之间的关系。他们发现,当为大鼠反复注射相同剂量的吗啡时,脊髓内活化的星形胶质细胞数量增多了。这种由反复注射吗啡诱发的胶质细胞变化,类似于组织受伤后或神经病理性疼痛产生时脊髓内神经胶质细胞的改变。然后,他们用毒素杀死星形胶质细胞,发现大鼠对吗啡的耐受程度显著降低,表明神经胶质细胞确实在某种程度上参与了吗啡耐受性的形成。
随后,很多研究小组利用多种手段阻断神经元与胶质细胞之间的信号传递(比如抑制神经胶质细胞上的特定细胞因子受体),并检测在这种条件下,机体对吗啡的耐受性是否受到影响。这些研究发现,注射阻滞剂,阻断神经胶质细胞发出的或传往神经胶质细胞的炎性信号,并不影响机体对急性痛的感知,但如果阻滞剂与吗啡同时注射,低剂量的吗啡就能起到正常剂量的镇痛效果,有效时间也延长了一倍。这些结果表明,的确是胶质细胞抵消了吗啡的镇痛效果。
神经胶质细胞削弱吗啡的功效,实际上是在执行最基本的任务:保持神经回路的平衡。麻醉剂降低了痛觉回路的敏感性,因此神经胶质细胞释放刺激因子,增强神经元的兴奋性,使神经回路的活动恢复到正常水平。随着时间推移,由于受到神经胶质细胞的影响,痛感神经元的敏感性逐渐增强,一旦停止注射海洛因或其他麻醉剂,对痛觉回路的抑制效果突然消失,神经元就会猛烈放电,变得非常敏感,产生令人痛苦的戒断症状。动物实验发现,抑制神经胶质细胞反应的药物,可以显著降低吗啡戒断反应。
调控神经胶质细胞的活动不仅是缓解慢性痛的关键,也降低了患者对麻醉剂上瘾的可能。疼痛和成瘾是人类的两大痛苦之源,对于一直在寻找方法控制它们的科学家来说,以神经胶质细胞为作用目标的药物是一个不错的选择。过去,正是神经元、疼痛和成瘾之间扑朔迷离的联系迷惑了科学家的双眼,使他们长期忽视了神经元的重要伙伴——神经胶质细胞。
请 登录 发表评论