生物学家过去一直认为,遗传突变导致疾病的过程已经研究清楚了。然而最新研究显示,事实远比科学家想象的复杂——DNA突变会以令人诧异,甚至违背直觉的方式致病。科学界的传统观点认为,“沉默突变”不会影响健康,因为这类DNA突变不会改变基因编码的蛋白结构。在细胞内,从催化生化反应到识别外来入侵物质,几乎每个生理过程都需要蛋白质的参与。因此,科学家曾经认为,只要蛋白质的最终构成没有出现偏差,在它们合成的过程中出现任何细微差错都不应该对身体造成危害。

然而,在研究某种疾病时,科学家偶尔会追踪到某种沉默突变,但他们仍认为,沉默突变不可能是导致疾病的罪魁祸首。在研究基因组进化时,科学家也曾被类似谜团困扰:各个物种的DNA变化模式表明,很多沉默突变并未在进化过程中消失,而是一直留存在DNA中。这一现象暗示,它们的存在能让生物体受益。在很多物种中,沉默突变似乎能提高细胞合成蛋白质的效率,但在人类中,科学家还没有观察到类似现象。
现在,研究人员正着手分析沉默突变对人类健康和疾病造成的影响,相关发现可以激发新的基因设计思路,提高医学和基因工程研究的水平。
基因密码
看到细胞如何制造蛋白质,你就会明白一个基因突变为何可以不影响蛋白结构。蛋白质合成的基本过程非常简单:一条DNA链转录生成相应序列的RNA链,RNA链被翻译成氨基酸链,最终氨基酸链自我折叠,形成具有特定结构的蛋白质。构成DNA的基本单元是4种核苷酸,我们可以根据它们携带的碱基进行区分:腺嘌呤(A)、胞嘧啶(C)、鸟嘌呤(G)和胸腺嘧啶(T)。而在RNA中,除了尿嘧啶(U)替代了胸腺嘧啶,其余碱基都是相同的。
蕴藏在核酸中的指令必须转换为“氨基酸语言”,它所代表的“含义”(即蛋白质)才能表达出来。基因开始表达时,DNA的双螺旋结构会部分解体,细胞的转录机器将一条DNA链转录为信使RNA(mRNA)。通常,细胞还会对mRNA进行一番修剪,形成更简短的结构后,核糖体和转运RNA(tRNA,一种更小的RNA分子,负责运送氨基酸)才开始“翻译工作”。在翻译过程中,核糖体会沿着mRNA序列移动,tRNA则将一个个氨基酸运送过来。每个tRNA都会运载一个特定氨基酸,并与mRNA上的特定三核苷酸序列(即遗传密码)结合。tRNA与对应mRNA序列完成配对后,核糖体就把tRNA运载的氨基酸添加到不断延长的氨基酸链上(见第53页框图)。
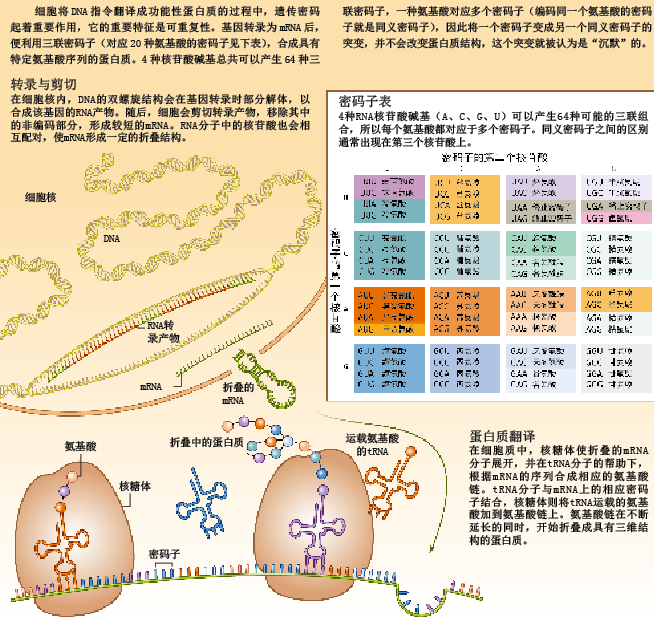
将DNA和RNA翻译成蛋白质时,细胞使用的代码(遗传密码)实际上就是一套规则,决定了哪个tRNA运载哪种氨基酸。这套代码体系有一个重要特点:可重复性。所有基因及相应mRNA都由若干个三核苷酸序列组成(因此遗传密码又叫做三联密码子),4种核苷酸可以构成64个三联密码子。其中,3个密码子作为RNA翻译的终止信号,其余61个密码子则用来编码20种氨基酸,因此绝大多数氨基酸都对应着多个三联密码子。例如,所有以GG(GGA、GGC、GGG和GGU)开头的密码子都会被翻译成甘氨酸,因此它们互为同义密码子。
点突变(point mutation)是DNA分子中发生的单碱基变异,可以把原来的密码子变成编码其他氨基酸的密码子[即错义突变(missense mutation)],或者变成终止密码子[即无义突变(nonsense mutation)],使最终的蛋白质产物变短。单碱基变异还可能使终止密码子变成编码某种氨基酸的密码子[即有义突变(sense mutation)],从而产生“加长版”蛋白产物。点突变造成的最后一种后果是,核苷酸序列虽然发生改变,但密码子编码的氨基酸却保持不变(即同义突变),这类突变被称为沉默突变(silent mutation)。
偏爱密码子
不论是错义突变、无义突变还是有义突变,都会严重影响人类健康,这样的例子不胜枚举。以编码红细胞中血红蛋白的基因为例,该基因上3种不同的点突变会导致3种严重疾病。造成镰刀形红细胞贫血症(sickle cell anemia)的错义突变,使一个亲水性氨基酸变成了疏水性的,导致血红蛋白极易凝集,形成镰刀状红细胞。在红细胞增多症(polycythemia disorder)中,无义突变导致一种血红蛋白变短,使血液变得黏稠。地中海贫血症(thalassemia)的病因,则是一种有义突变将终止信号(TAA)变成编码谷氨酸的密码子(CAA),形成一种氨基酸序列较长的无功能蛋白。
直到20世纪80年代,科学家才意识到,沉默突变也可能影响蛋白质的合成,至少在细菌和酵母菌中是这样。当时,一个重要发现显示,在这些微生物的基因中,各个同义密码子出现频率都不一样。在大肠杆菌(Escherichia coli)DNA中,天冬酰胺(asparagine,一种氨基酸)密码子AAC的出现频率远高于另一个同义密码子AAT。细胞为什么偏爱某一些密码子?因为利用这些密码子,它可以更快更准确地合成蛋白质。
在细胞中,各种同义密码子对应的tRNA的含量通常存在一定差别。更重要的是,在一个基因中,与高含量tRNA相匹配的密码子越多,该基因就能更快地表达,因为tRNA含量越高,就更容易出现在细胞需要它们的地方。在另一些情况下,某种tRNA虽能与多种同义密码子配对,但更“喜欢”与其中一种结合,使用这种密码子的基因能最大限度地提高合成蛋白质的准确度。可见,细胞不平均使用所有同义密码子的理由非常充分。在细菌和酵母菌中,编码高含量蛋白的基因在密码子的使用上表现出了极强的偏爱性,它们最偏爱的密码子恰恰对应着最常见或结合力较强的tRNA。
对其他生物体的研究显示,植物、果蝇和蠕虫也有类似的密码子偏爱性。既然如此多的生物都利用这种方式来提高蛋白质的合成效率,哺乳动物体内似乎也应该存在同样的分子机理。分析哺乳动物的基因时,科学家证实了这一推论。然而进一步研究却表明,低等生物与哺乳动物之间的这种相似性只是一种表面现象。由于某些未知原因,哺乳动物的基因组通常分为很多大型区域,每个区域中的核苷酸组成都有不同的特征:一些区域富含G和C,另一些区域则富含A和T。由此产生的结果是,如果一个基因位于基因组中富含GC的区域,其中很多密码子就都含有GC碱基。我们的基因确实表现出了对特定密码子的偏爱,但与简单生物不同,哺乳动物对密码子的偏爱模式并未明确显示,这样的偏爱是为了优化蛋白质的合成。
多年来,不少研究似乎都为“沉默突变不会影响人体功能”提供了重要证据,然而从21世纪初开始,通过比较不同物种的同种基因,科学家逐渐意识到这种传统观点并不正确。我们可以对比核苷酸发生过变异和核苷酸组成始终保持不变的基因位点,从而测定某个基因在两个物种中的分化速率。理论上讲,自然选择会忽略对生物体没有任何影响的突变,只保留对物种有益的变异。根据当时的看法,基因上发生过沉默突变的位点以及占基因组98%的非编码DNA,都应该是被自然选择忽略的区域。但科学家在观察沉默突变位点与非编码DNA,看它们的进化速度是否相同时,却意外发现它们的进化速率并不相同——这预示着沉默突变可能会影响生物体的生理活动。
致病的沉默
最初,科学家不知道沉默突变如何在哺乳动物中干扰蛋白质的合成。但在不久前,疾病研究揭开了谜底,而且答案还不止一个:从DNA转录到mRNA被翻译成蛋白质,致病沉默突变的干扰效应能在蛋白质合成的多个阶段发挥作用。
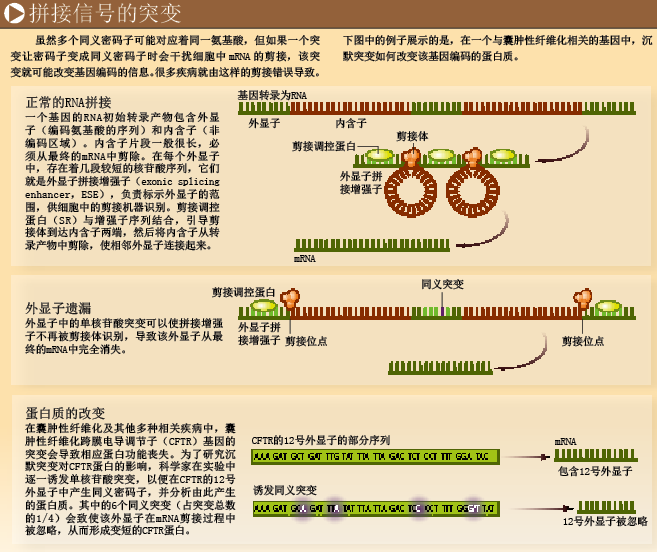
沉默突变影响细胞“修剪”基因转录产物便是例子之一。基因转录为RNA后不久,其中的非编码区域[即内含子(intron)]就会被剪除。就像剪辑电影一样,细胞中的剪接机器会找出转录产物中编码氨基酸的片段[即外显子(exon)],将这些片段剪接在一起,形成成熟的转录产物——mRNA。人类基因组中的内含子特别多,每个基因平均含有8个较长的内含子,因此剪接机器需要通过某种方式辨别外显子的起止位点。
过去几年的研究发现,外显子不只编码氨基酸,它们的序列还含有移除内含子所必需的信息。其中最重要的部分是外显子拼接增强子(exonic splicing enhancer,ESE)序列。它们由3~8个核苷酸组成,位于外显子末端,用于界定外显子的位置,便于剪接机器发挥作用。实际上,拼接增强子的存在可以解释人类基因为何偏爱某些核苷酸:虽然GGA和GGG都是编码甘氨酸的密码子,都可以出现在拼接增强子中,但由于GGA对于外显子剪接的增强作用更大更有效,因此它在外显子末端更为常见。
拼接增强子中存在某些密码子的观点也得到了其他研究的证实。我们与英国巴斯大学的同事乔安娜·帕姆利(Joanna Parmley)进行的一项研究显示,在明显表现出拼接增强子功能的外显子序列中,同义密码子的进化速度要比不具有剪接功能的相邻序列慢。这种缓慢的进化其实在向我们暗示,由于这些增强子序列非常重要,自然选择不让它们轻易发生改变。在这类增强子中,密码子发生沉默突变虽然不会引起氨基酸序列的改变,但仍会对蛋白质合成产生重大影响,因为这样的突变会干扰内含子的正常移除。
美国布朗大学工作的威廉·费尔布罗瑟(William Fairbrother)和他以前在麻省理工学院克里斯托弗·伯杰(Christopher Burger)实验室的同事,在比较外显子的末端序列时发现,这些序列在不同人群中的相似度非常高,而且变异率很低,即使在可能发生过沉默突变的位点也是如此。实际上,外显子末端并非没有发生突变,而是因为突变一旦发生,就会破坏蛋白质的合成过程,对人体产生危害,因此逐渐被自然选择抛弃。
至今,大约50 多种遗传疾病都被证实与沉默突变有关,其中很多突变都影响到内含子的移除。拼接增强子可以与某个基因的一大段蛋白编码序列重合,因此对于细胞而言,如果这样一段序列发生沉默突变,将会严重影响细胞功能。最近,意大利国际基因工程与生物技术研究中心(International Center for Genetic Engineering and Biotechnology)的弗朗西斯科·巴拉勒(Francisco Baralle)就向我们展示了这样一个惊人例证。研究人员数次在囊肿性纤维化跨膜电导调节子(cystic fibrosis transmembrane conductance regulator,CFTR)基因中诱发沉默突变,结果发现25%的突变会影响RNA的剪接,并可能导致囊肿性纤维化或其他相关疾病。
这并不是说干扰RNA剪接是沉默突变致病的唯一机制。即使内含子被准确去除,mRNA也不一定能折叠成正确结构。mRNA并非一段无结构的线性分子,就像两条DNA链之间的核苷酸会相互配对一样,mRNA不同区域之间也可以通过核苷酸配对,形成精妙的折叠结构,即所谓的茎环结构(stem-loop)。mRNA的折叠方式决定了自身的稳定性、核糖体的翻译速度,以及最后被细胞“垃圾处理系统”降解的速度。
多巴胺D2受体是一种细胞表面蛋白,能检测神经递质多巴胺的存在。如果编码该受体的基因发生沉默突变,会致使mRNA迅速降解,合成的蛋白数量减少,造成认知障碍。相反,儿茶酚氧位甲基转移酶(catechol-O-methyl transferase,COMT)基因发生沉默突变,会使mRNA过度折叠,形成更复杂的结构,以至于在翻译开始前难以解体,因此降低蛋白合成量。美国北卡罗来纳大学查佩希尔分校的安德里亚·G·奈克雷(Andrea G. Nackley)及其同事发现,这种突变会影响人们对疼痛的忍耐能力。如果告诉你这项研究是在牙医学校进行的,或许你就不会感到吃惊。
另一个沉默突变直接影响蛋白质的例子与多重耐药性基因—1(multidrug resistance 1)有关。这个基因编码的蛋白质是一种细胞泵,能帮助癌细胞排出化疗药物,从而获得耐药性并因此得名。美国国家癌症研究所的沙瓦·金奇-萨尔法蒂(Chava Kimchi-Sarfaty)和同事发现,沉默突变会导致上述基因编码的细胞泵折叠异常,削弱癌细胞排出药物的能力。由于蛋白质的翻译和折叠过程可以同时进行,研究人员推测,沉默突变可能产生了一种罕见的同义密码子,导致翻译暂停,而使蛋白质有充足时间形成异常结构。如果推测正确,那又是何种原因导致“暂停事件”呢?目前我们还无法回答,这个未解之谜也许与基因和蛋白质的运作机理有关。
改造基因
科学家可以从最近关于沉默突变的研究发现中得到一个教训:提出假设时应该格外谨慎。在发现沉默突变与蛋白质合成速率之间的关系前,人们曾坚定不移地认为,同义突变一定是“沉默”的,但鉴于我们提到过的惊人例子,这个观点显然站不住脚了。
对沉默突变新的认识,有助于研究人员改进基因工程技术。如果知道一个基因中哪个核苷酸必须保留,哪个可以替换,研究人员就可以直接改造该基因。不论是基因治疗还是利用动物或微生物规模化生产药用蛋白,都有赖于设计、改造并把基因插入细胞基因组的能力。构建一个能高效工作的基因非常困难,最大的挑战是,如何确保新转入的基因在细胞中活跃表达,合成足够的蛋白。从这个意义上说,同义(却不沉默的)突变会对转基因研究造成非常大的影响。
在人类基因中,大多数内含子似乎都不是必需的(通常只有基因中的第一个内含子对于蛋白合成可能是必需的)。这个发现意味着,我们在构建转基因(transgene)时,可以移除内含子,让基因变得更简洁。我们还可以改变某些沉默位点(silent site),却不会产生有害影响,因为一旦移除内含子,就不再需要拼接增强子了。这些限制一旦解除,遗传学家就能在其他方面利用这些沉默位点。
波兰国际分子与细胞生物学研究所(International Institute of Molecular and Cell Biology)的一项最新研究,展示了如何利用沉默位点来造福人类。格热戈日·库德拉(Grzegorz Kudla)及其同事以3个基因为研究对象,在沉默位点处改变了特定核苷酸的相对比例,然后将这些基因转入哺乳动物细胞中。他们发现,GC含量的增加能显著提高基因活性,蛋白合成效率也是GC含量较少时的100倍。
沉默突变普遍存在?
上述新的认识也促进了我们对致病机理的理解。目前正在进行的基因图谱绘制计划的目的,是寻找人体内的基因变异,但该计划对于寻找致病基因也很关键。鉴别某种疾病患者体内的所有点突变,科学家就能锁定基因组中含有致病基因突变的区域。
直到最近,科学家仍认为,如果一个基因上的多个突变都与某种疾病相关,其中改变氨基酸序列的突变就肯定是致病因素。比较著名的例子就是与疼痛忍耐能力相关的COMT基因。在这个基因中,一个已知突变会将蛋白产物上的一个氨基酸替换为另一个,科学家长期认为,该突变是削弱疼痛忍耐能力的唯一原因。然而一项研究显示,在疼痛忍耐能力极强和很弱的人体内,这个突变位点上的核苷酸是相同的。这就意味着,导致疼痛忍耐能力不一致的因素肯定不止一个。只要沉默突变影响基因表达的机理一经证实,人们就会接受COMT基因上的沉默突变才是致病元凶的实验结果。
有时,我们可能会把某些疾病的致病原因错误地归咎于氨基酸序列的突变,但真正导致疾病的却可能是同义突变。当研究人员在庞杂的基因组数据中寻找破坏性突变时,必须谨记这一点——在寻找过程中,谁知道是否还会出现其他致病机理呢?
目前的研究结果是否表明,沉默突变经常导致疾病?有可能。你可以辩解说,沉默突变的确很有意思,相关研究也具有重要的实用价值,但要说它们是多种疾病的致病因素,证据却不明显。最近关于基因进化的研究让这些辩解显得有些苍白。几年前,本文作者之一赫斯特发现,与早发性乳癌有关的BRAC1基因的一个片段中,多个沉默位点的进化在人类和啮齿类动物中都很缓慢。与此相反,这个基因的其余序列却以正常速度进化。为什么会存在如此差异?原因并不一定是沉默位点发生突变的几率比其他序列低,更可能是该位点发生了突变的个体在将遗传信息传给下一代之前就死亡了。随后的研究证实,上述片段正好处于拼接增强子的位置。换句话说,这个例子又一次证明,沉默突变的影响大到足以让生物体死亡。
在基因片段中,因为自然选择的压力,沉默位点一直保持不变的现象到底有多普遍?为了弄清这个问题,本文作者赫斯特和帕姆利通过基因扫描,开始寻找一些特殊区域:在这些区域中,沉默位点的进化速度明显不同于那些能改变氨基酸序列的突变位点。结果发现,沉默位点进化缓慢的DNA区域其实很普遍,甚至比那些进化较快、编码氨基酸的区域更普遍。在基因序列中,上述沉默位点每隔10,000~15,000个核苷酸就会出现一次。
我们估计,5%~10%的人类基因都含有至少一个可能发生破坏性沉默突变的区域。美国加利福尼亚大学圣克鲁兹分校的彼得·沙特纳(Peter Schattner)和马克·迪耶克汉斯(Mark Diekhans)也进行了一项分析研究,从基因中寻找具有极低突变率的沉默位点的区域。他们估计,在检测的近12,000个基因中,大约有1,600个这样的区域。这与我们的研究结果十分相近。然而,这两个估计值可能还是偏低,真实值也许会高得多。如果这些沉默位点发生的沉默突变会导致疾病,无视它们必将让科学家对疾病相关突变产生误判。
在认识到自然选择确实曾作用于那些“不那么沉默”的突变的同时,科学家也意识到,基因表达的过程远比我们之前想象的更复杂、更精细。对基因进化与运作模式之间的紧密关系,直到10年前,我们仍几乎一无所知。通过对这些过程的深入研究,基因组运作方式的复杂性将进一步展现在我们面前:DNA并非简单的线性分子,而是盘绕成螺旋结构;在进行转录时,这个结构必须部分解体。在这个过程中,细胞的调控机制是否也在沉默位点中留下了印记?细胞对罕见密码子的使用频率比理论上更高,这些密码子的功能是什么,原理又是什么?
对于这些问题的解答,不仅有助于我们更好地了解蛋白质合成的过程,更会为疾病的治疗带来新的思路。
请 登录 发表评论