除了有点细小、表面覆盖着一层黏液,蝾螈(salamander)的四肢与人类的有很多相似之处:表面覆盖着一层皮肤,内部则由骨骼、肌肉、韧带、肌腱、神经、血管等组织构成。这些组织通过松散排列的成纤维细胞(fibroblasts)连接在一起,并保持特定形态。
神奇的是,蝾螈的肢体被切除后,会从切除部位长出新的肢体。在脊椎动物的世界里,蝾螈的这项本领堪称绝无仅有。而且,不论肢体被切除多少次,成年蝾螈都可以反复再生。实际上,小蝌蚪在刚开始长肢体时,也具有再生能力,但成年后,这种能力就失去了;哺乳动物尚处于胚胎期时,正在发育的肢芽(limb bud,将来发育成四肢)也能再生,但出生后,这种能力将完全消失。在向高等动物进化的过程中,动物的再生能力明显退化,因此进化地位较低的蝾螈,便成为了唯一终生具有肢体再生能力的脊椎动物。
蝾螈为何具有如此强大的再生能力?它们的肢体如何得知缺失了多少,并再生出合适的“替代品”?为什么它伤口处的皮肤不像人类的那样,只是包裹缺失部位,最终形成一个无法消除的疤痕?成年蝾螈又如何保持胚胎时期的再生能力,总能让缺失的肢体完美再生?长期以来,生物学家孜孜不倦地寻求着答案——如果知道了蝾螈肢体再生的生物学机制,就可以利用同样的原理,让人类断肢再生。
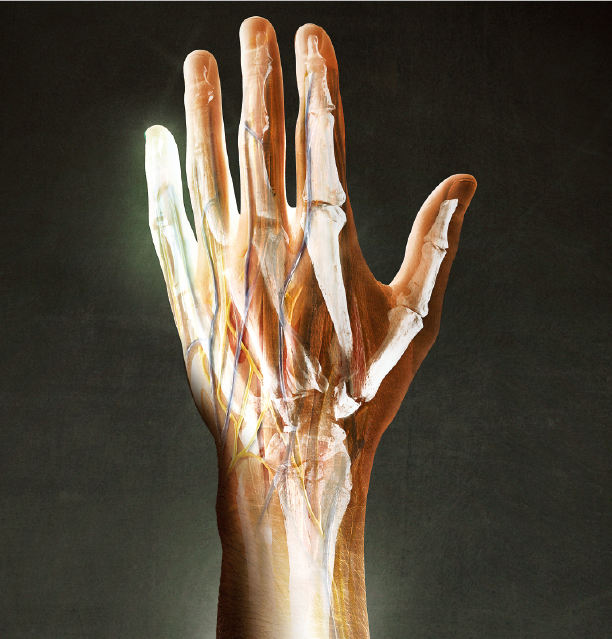
遭受严重创伤之初,人类与蝾螈的机体反应并无太大区别,但在伤口愈合过程中,差异却越来越明显。我们身上的疤痕早已证明,人体器官无法再生。但也有迹象表明,人类仍具有再生复杂组织的潜能。问题的关键是,如何才能激发这种潜能,让人类获得“蝾螈式”的再生能力?
蝾螈给我们的启示
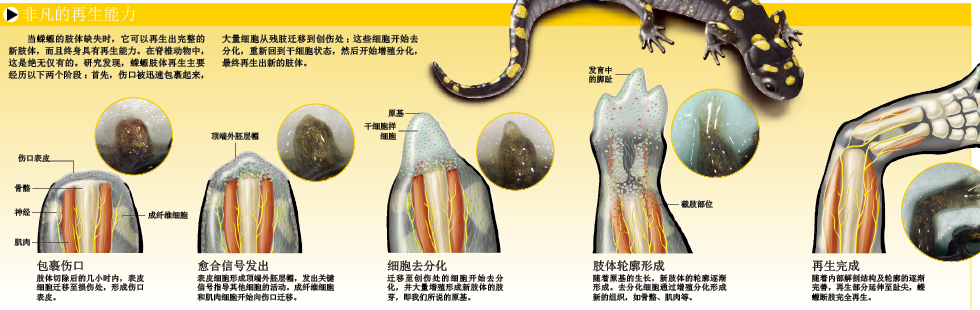
蝾螈的肢体被切断后,损伤部位的血管迅速收缩,减少血液损失量,一层表皮细胞随即覆盖伤口。受伤后的最初几天,这些细胞会转变成信号细胞层(即顶端外胚层帽,apical epithelial cap,缩写为AEC),在再生过程中起着不可替代的作用。与此同时,成纤维细胞从结缔组织中游离出来,迁移至损伤部位,并向切面中央聚集。然后,成纤维细胞开始增殖,形成原基(blastema)——这个干细胞样细胞(stem-like cells)的集合体,就是新生肢体的“起点”(见第52页图)。
很多年前,我们的同事、美国加利福尼亚大学欧文分校的苏珊·布莱恩特(Susan Bryant)研究证明,构成原基的细胞与蝾螈胚胎的肢芽细胞功能相似——这就是说,通过原基再生肢体,相当于重演动物胚胎期的肢体发育过程。据此,我们可以得出结论:肢体再生与胚胎期的肢体发育受到相同遗传程序的控制。由于人类的四肢也是在胚胎期开始发育,从理论上来说,我们应该具有四肢再生所必需的遗传程序。只要科学家能弄清楚,如何诱导断肢部位形成原基,人类断肢再生似乎就能变成现实。
几年前,本文作者之一加尔迪耶曾与加利福尼亚大学的特苏亚·恩多(Tetsuya Endo)教授一起,使用非常简单的方法,初步研究了原基的形成过程。研究中,他们并未将重点放在形成原基的断肢部位,而是研究蝾螈肢体上的细微创伤,这类创伤只要皮肤再生就能愈合。与哺乳动物的断肢一样,蝾螈肢体上的细微伤口也无法再生新的肢体,如果能让这样的伤口再生出完整肢体,我们对蝾螈肢体的再生过程就更加清楚了。
当我们在蝾螈的肢体上划出一道伤口,表皮细胞迅速迁移至创伤处覆盖伤口(和断肢后的反应一样),真皮层的成纤维细胞也匆匆赶到伤口处,补充缺失的细胞,从而替代失去的皮肤。但如果把一根神经纤维移至创伤处,情况立即改变:成纤维细胞将形成原基。实际上,早在半个多世纪前,美国华盛顿天主教大学的马库斯·辛格(Marcus Singer)就证明,在再生过程中,神经支配必不可少。我们的研究则进一步阐明,来自神经的某种未知因素,可以改变成纤维细胞的行为,进而影响肢体再生过程。
不过,神经诱导出的原基无法成为肢体再生的起点,因为缺乏一个关键因素。我们发现,要诱导出“有效”原基(能再生出新的肢体),必须在伤口的背面切下一块皮肤,移植到伤口处,让移植皮肤里的成纤维细胞参与伤口愈合反应。新的肢体的确从蝾螈的伤口处长了出来。尽管再生部位看起来有些怪异,但在解剖学上,新生肢体完全正常(见第52页图)。通过上述实验,我们不难得出结论:伤口处的表皮细胞、神经以及伤口背面的成纤维细胞,是产生有效原基的三大要素。鉴于此,我们开始重点研究这三个要素在再生过程中的作用。
我们知道,表皮由早期胚胎中的外胚层(ectoderm)发育而成,而外胚层中的原始细胞(primitive cell)会向肢芽聚集,形成顶端外胚层嵴(apical ectodermal ridge,缩写为AER),然后释放化学信号,引导肢芽细胞的迁移和增殖,从而调控肢芽的发育过程(最终结果是形成四肢)。
尽管我们还没有鉴别出表皮发出的所有关键信号,但可以确定的是,成纤维细胞生长因子(fibroblast growth factor,缩写为FGF)就是一类信号分子。顶端外胚层嵴可以分泌大量的成纤维细胞生长因子,刺激肢芽细胞分泌其他类型的成纤维细胞生长因子,再来影响顶端外胚层嵴,形成一个正反馈信号通路——在肢体发育过程中,这个通路的作用非常关键。同样,在肢体再生过程中,由于顶端外胚层帽的刺激,也会产生作用相似的信号通路。日本东北大学的井出弘之(Hiroyuki Ide)教授在研究中发现,蝌蚪在发育过程中失去再生能力,与它们无法激活上述信号回路有关;但是,如果切除已丧失再生能力的蝌蚪的肢体后,利用成纤维细胞生长因子-10刺激伤口,信号通路将重新激活,再生出部分肢体。
然而,井出弘之教授没能高兴太久,他很快发现,蝌蚪再生肢体的结构极不正常。这个失败的试验暗示:蝌蚪再生肢体时,机体调控过程可能出现了重大失误。因此,只有知道蝾螈和小蝌蚪如何调控再生过程,我们才能正确启动再生程序,让成年动物再生出正常肢体。多次实验之后,我们发现,成纤维细胞起着非常重要的再生调控作用。
定位是关键
我们已经知道,仅有成纤维细胞不足以触发再生过程。在轻微创伤时,伤口的成纤维细胞会参与创伤修复,却不会“制造”新的肢体。只有来自断肢上的成纤维细胞,才能启动再生过程。这个发现表明,成纤维细胞所处位置,对于再生程序的启动至关重要。在胚胎时期,肢体的发育是循序渐进的:先形成肩部和髋部,再在此基础上发育出肢体,最后在肢体末端长出手指和脚趾。对于蝾螈来说,不论在什么位置切除肢体,它都可以恰到好处地再生缺失部分,新的肢体与原来的完全一样。
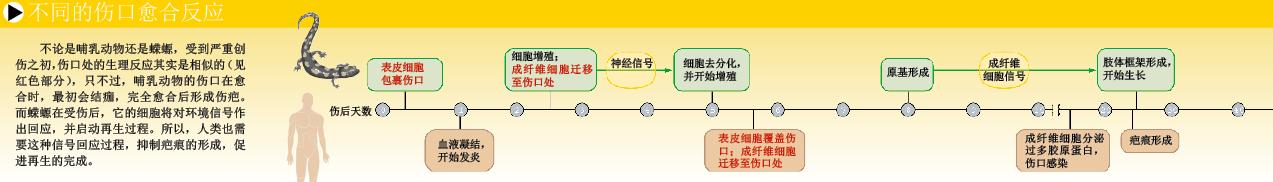
蝾螈的再生反应说明,断肢处的细胞一定“知道”它们的位置在哪里。各种细胞和分子正是在位置信息的调控下,才再生出了缺失的肢体。但是,谁在编码细胞的定位信息?答案就是基因。如果能检测出哪些基因参与了位置信息的编码过程,我们就可以弄清楚肢体再生的生理机制。
在胚胎期,很多基因都与肢体细胞的定位有关,但最关键的,当数Hox基因家族。绝大多数动物的肢芽细胞,都是利用Hox基因编码的位置信息,才发育成完整的肢体。但是,肢体一旦发育完成,其中的细胞就“忘记”了自己来自何处。相反,成年蝾螈肢体中的成纤维细胞一直保留着相关信息,肢体被切除后,它们就可以重新启用Hox基因编码的位置信息,指导再生过程。
再生过程中,携带着位置信息的成纤维细胞迁移到断肢处,促使原基的形成。进入原基后,细胞们便可以相互“交流”,评估肢体受损程度。虽然还无法得知细胞“交流”的内容,但我们知道,“交流”的最终结果肯定是确定再生部分的轮廓。然后,细胞利用位置信息,逐步填补缺失的肢体部分,再生出完整肢体。
肢体主要由肌肉和骨骼组成,因此我们很想知道,在再生过程中,构成肌肉和骨骼的成分从何而来,它们又是如何形成肌肉和骨骼的?在肢体再生之初,一个非常关键的过程就是细胞的去分化(dedifferentiation)。这个生物学术语通常是指,成熟细胞重新返回干细胞状态,具有分化为一种或多种组织的潜能。
在再生领域,科学家早期发现的去分化其实是另一种现象:他们利用显微镜观察蝾螈的断肢时,发现肌肉组织竟然分散开,形成大量可增殖细胞,进而产生原基。但现在,我们已经知道,可增殖细胞其实来源于肌肉组织的干细胞(stem cell),而不是由肌肉细胞去分化形成的。尽管如此,后来的科学家试验发现,肢体再生过程中确实存在去分化现象。原基中的成纤维细胞去分化成硬骨和软骨细胞,进而形成骨骼组织;也可以再分化为成纤维细胞,给新的肢体提供内部框架。
再谈谈构成原基的另一种重要细胞——表皮细胞。在再生过程中,它同样有去分化能力。在胚胎期,外胚层中的很多基因都与肢体的发育有关(如Fgf8和Wnt7a),但当外胚层分化为成熟表皮后,这些基因就失活了。成年蝾螈的肢体被切断后,虽然一些表皮细胞迅速迁移至伤口处,但这一过程最初激活的基因,其实与肢体再生没有关系,只会合成一些促进伤口愈合的角蛋白(keratin)等。随后,伤口处表皮细胞中Fgf8和Wnt7a基因被激活,这两个基因决定了表皮细胞的去分化与否——从本质上来说,去分化过程是表皮细胞(及其他类型的细胞)的特定基因重新激活。
通过对蝾螈的研究,我们将再生过程分成以下几个阶段:最初是伤口愈合反应;接着,一些去分化程度各不相同的细胞聚集在一起,形成原基;最后,发育程序启动,新的肢体形成。基于上述结果,我们开始研究如何刺激人类四肢的再生。
揭秘那些尚未发生的现象,或许是科学研究中最大的难题,让人类四肢再生正是其中一例。虽然人类四肢再生尚无先例,但并不意味着我们完全没有再生能力。
人的再生潜能
实际上,人类的指尖本身就具有再生能力,因此再生人类四肢并不是不可实现的目标。早在30年前,就有科学家首次报道婴儿的指尖再生现象。此后,陆续有文章指出,青少年甚至成年人的指尖也能再生。不小心切除指尖后,让它再生似乎再简单不过:清洗伤口,再用纱布包裹就行了。但是,发生在纱布里的事,却非常复杂:受损指尖不仅要重建轮廓、指纹,恢复触觉,还要根据受损情况,适当延伸长度。不少医学杂志都报道过多例指尖修复的病例。有趣的是,将皮瓣(皮肤和皮下组织构成的组织块)缝合到指尖上,是治疗指尖受损的一种代表性方法,但这恰恰会抑制再生过程。即便是蝾螈,也会受到缝合手术的影响,因为它干扰了伤口处表皮的形成。从这些报道中,我们得到一个非常重要的信息:人类本来具有再生能力,但遗憾的是,这种能力被传统医疗手段抑制了。
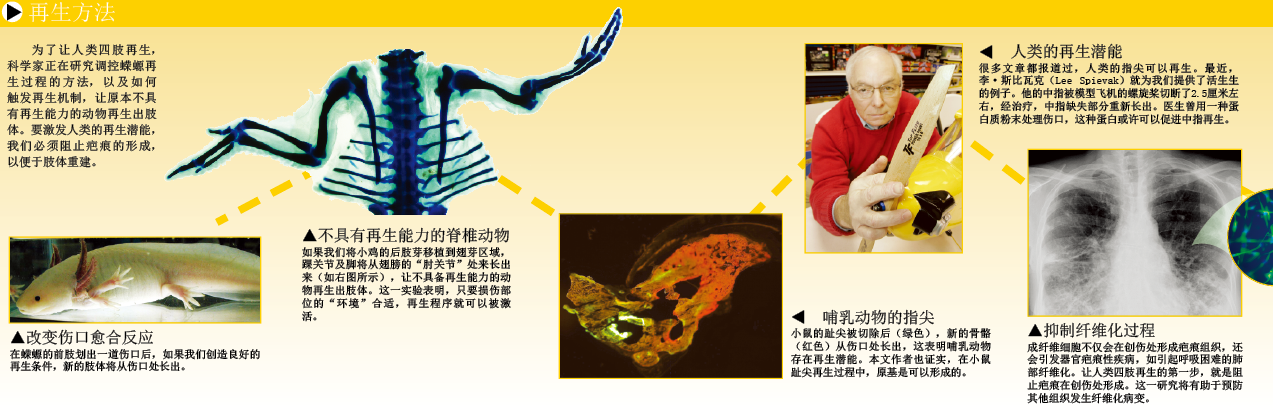
研究指尖再生的机理并非易事,因为人不能作为研究对象。不过,一些科学家发现,低龄和成年小鼠和人类一样,也有趾尖再生能力。近年来,本文两位作者穆内奥卡和韩万钟详细研究了小鼠的趾尖再生情况,结果发现,小鼠趾尖被切除后,伤口处的确生成了表皮,但与蝾螈相比,表皮的生成速度要慢得多。我们还发现,小鼠再生趾尖时,在一些正在增殖的未分化细胞中,胚胎基因非常活跃——这就表明,未分化细胞是原基的组成部分。
为了弄清特定基因和生长因子在小鼠趾尖再生过程中的作用,我们培养了一种小鼠组织,作为胎鼠趾尖再生的研究模型。我们发现,如果人为地抑制骨形态发生蛋白-4(bone morphogenetic protein 4,缩写为BMP4,一种生长因子)的表达,趾尖再生过程就会被抑制。缺失Msx1基因的突变小鼠也无法再生趾尖,因为这个基因对骨形态发生蛋白-4的合成至关重要。但是,如果在伤口处添加骨形态发生蛋白-4,突变小鼠就能恢复再生能力。这一结果证实了骨形态发生蛋白-4在再生过程中的重要作用。
美国罗伯特·伍德·约翰逊医学院的科利·阿巴特-舍恩(Cory Abate-Shen)教授和同事研究证明,在胚胎发育期,Msx1基因编码的蛋白可以抑制多种细胞的分化。Msx1基因对细胞分化的调控作用说明,它编码的蛋白可以触发细胞的去分化,促进肢体再生。尽管在蝾螈肢体的再生过程中,Msx1基因并未从一开始就参与细胞去分化,但与它同属一个基因家族的Msx2基因,却是再生过程中最早被激活的基因之一,所起的作用与Msx1很相似。
再生断肢,何时实现?
现阶段,再生人类四肢似乎是难以企及的梦想,但通过对再生机制的深入研究,我们相信这个梦想会成为现实。切除人类四肢会导致大范围创伤,同时切断各种组织,包括表皮、真皮、结缔组织、脂肪、肌肉、骨骼、神经和血管。如果一一分析这些组织,我们会发现,绝大多数组织在轻微损伤时都有再生能力。
构成四肢的组织中,真皮不具备再生能力。真皮组织由许多不同的细胞构成,其中成纤维细胞占有较大比例。当人类或其他哺乳动物受伤后,这些成纤维细胞会参与纤维化过程(fibrosis),让大量的细胞外基质在伤口处沉积,以促进伤口愈合。由于细胞外基质无规律排列,伤口愈合后,就会留下明显的疤痕。纤维化过程不仅抑制哺乳动物的再生过程,它本身也会引发严重的医学问题。很多器官(如心脏、肝脏)受到损伤,或发生病变后,接下来的纤维化过程可能影响器官的正常功能。
对深度创伤的研究表明,在损伤修复过程中,伤口处的成纤维细胞有两个来源:真皮组织和血液循环中的成纤维细胞样干细胞(fibroblast-like stem cell)。当我们受伤后,一些免疫细胞迅速赶到伤口处,发出信号,将上述两种来源的成纤维细胞也引导至伤口处。随后,成纤维细胞开始大量增殖,分泌细胞外基质——蝾螈启动再生反应时,也会经历这个过程。但成纤维细胞的行为差异,却导致了两种截然不同的结果:哺乳动物的成纤维细胞过量分泌细胞外基质,导致基质异常交联,最终只能形成疤痕;相反,蝾螈的成纤维细胞只会分泌适量的细胞外基质,用于重建正常的交联结构,为再生新的肢体打下基础。
不过,婴儿是哺乳动物中的特例。他们皮肤上的伤口愈合时不会形成疤痕,而是再生出新的皮肤。这就表明,伤口处的纤维化过程转变成了皮肤的发育过程。尽管这种变化反映了成纤维细胞生物学特性的改变,但更确切地说,这是由于细胞外环境发出的信号改变了成纤维细胞的行为。说到这里,我们似乎可以得出这样一个结论:在治疗过程中,如果改变伤口处的环境信号,就能改变愈合反应。但问题是,即使是在婴儿发育期,断肢也无法再生。因此,伤口愈合时不产生疤痕,只是再生的必要条件,但不是充分条件。
为了进一步研究如何诱导人类四肢的再生,我们仍以小鼠为研究对象。以前的研究已表明,在小鼠的断肢上,原基是可以形成的,而我们未来一年的目标是,在不能产生原基的部位上,诱导原基产生。就像研究蝾螈的肢体再生一样,我们首先要确定,原基的形成至少需要哪些前提条件。我们还希望在研究中发现,原基本身能否发出关键信号,抑制创伤处的纤维化进程。
如果我们成功诱导出原基,接下来的任务就是让断指再生。不过,这项任务的难度,远非指尖再生可以比拟,因为完整的手指包括各个关节,而关节是在胚胎发育期形成的、结构极其复杂的骨骼组织。直到今天,发育生物学家仍在研究天然关节的形成机理,因此重建小鼠的“手指”,在再生医学领域将具有里程碑意义。我们希望在今后几年完成这项任务,然后,再生出整个小鼠的“脚掌”、四肢……
如果综合考虑所有与伤口愈合、组织再生有关的研究,我们或许会得出一个惊人的结论:再过10~20年,科学家能让人类四肢再生。比较成纤维细胞在蝾螈再生过程以及哺乳动物纤维化过程中的行为差异,我们不难发现,这类细胞将是科学家成功的关键。美国斯坦福大学的张元豪(Howard Chang)和约翰·利恩(John Rinn)最近也有令人兴奋的发现:人类的成纤维细胞与蝾螈类似,都会保留胚胎期身体构建所需的空间定位信息。如果这些信息确实对蝾螈的再生有指导意义,人类成纤维细胞中保留的信息,也有可能激活再生四肢所必需的发育程序。
目前,对于蝾螈肢体再生的机理,我们已经有了深入的了解,不久的将来,我们也许就能将这种非凡能力转移到人类身上,让病人可以随意替换某种受损或者病变组织。
请 登录 发表评论