10年前,本文两位作者(兰格和瓦坎蒂)为《科学美国人》撰写一篇有关组织工程前景的文章时,提出了一个观点:根据组织工程原理,利用非生物材料和细胞可以“重建”人类活体组织。对当时的很多人而言,这个想法太不可思议了。然而,人们一直都迫切希望得到可移植器官,用于替换、重建或者提升组织功能。到今天为止,近5,000万美国人接受过各种形式的人工器官替代疗法,使生命得以延续;在发达国家,65岁以上的老人中,1/5的人的晚年生活都受益于器官移植技术。
目前的器官替代技术,包括全器官移植和肾脏透析,已挽救了无数生命,但这些技术尚不完善,也给病人带来了沉重负担。工程生物组织可以定制,具有良好的免疫相容性,为需要接受器官移植的病人提供了更佳选择。此外,工程组织还能满足人们的其他需求,比如用于体外测试某些试验药物的毒性。
从简单的细胞集合物、细胞薄片,到拥有三维结构的复杂组织,工程组织可以有多种形式。对科学家来说,构建能正常发挥功能的完整器官或许算是终极挑战。在10年前的文章中,我们讲述了构建可移植组织所面临的困难。如今,科学家在很多方面都已取得重大进展。利用组织工程皮肤和软骨等替代组织,医生已治疗了成千上万的病人;膀胱、角膜、支气管、血管等人造组织已进入临床试验阶段;在实验室构建结构更复杂的组织方面,科学家也取得了令人兴奋的成果。
尽管我们仍然面临不少困难,但10年来,对于人体组织在胚胎发育期和伤口愈合期的自然形成过程,我们有了更深入的认识。同时,用于“装配”组织结构的工程技术更加成熟,研究人员需要的化学、生物和机械材料也更容易获取。因此,组织工程的时代即将到来,组织工程产品将越来越多地用于临床治疗。
人造血管
人造皮肤和软骨最早进入临床试验,因为这类组织不需要大量的内部血管。但大多数组织都具有复杂的血管系统,血液供应难题一直限制着工程组织的尺寸。基于这个原因,许多科学家致力于制造人工血管,以用于工程组织。
任何厚度超过100微米的组织都需要一个血管系统,因为组织中的每个细胞都必须非常接近毛细血管,以吸取不断从血管中逸出的氧气和营养成分。如果缺少了这些物质,细胞很快就会受到不可恢复的损伤。
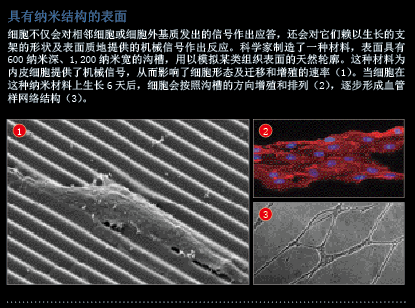
过去几年,很多构建组织内外血管的新技术问世,科学家对内皮细胞(endothelial cell,构成毛细血管和主血管的细胞)所需环境认识的提高,以及在极端微小的尺度下控制材料形状的能力的改善,为这些新技术的诞生奠定了基础。例如,如果我们以一种表面具有纳米沟槽的材料为支架,在上面培养内皮细胞,它们就会形成一个毛细血管网络(见第49页图片)。表面沟槽模拟了内皮细胞形成天然血管时,它们所依托的组织结构表面,因此这种支架材料为血管形成提供了重要的环境信号。
科学家还把用于制作电脑及手机微电子芯片的微加工技术,引入到毛细血管网络的构建中。瓦坎蒂曾与美国马萨诸塞州德雷珀实验室(Draper Laboratory)的杰弗里·T·博伦斯坦(Jeffrey T. Borenstein)合作,直接在可降解高分子支架材料内构建微通道阵列,模拟组织中的毛细血管网络。然后,他们在通道里培养内皮细胞,让它们形成血管。同时,内皮细胞也可作为天然屏障,最大限度地减轻血液细胞黏附效应对支架材料的影响。另外,我们在构建组织时,也可以用一种滤膜来隔离运送血液的微通道与组织中的功能性细胞(见第45页图)。
另一种既能把功能性细胞和血液隔离,又能让它们的距离足够近以便交换各种分子的方法是,把细胞悬浮在水凝胶支架材料中。这种材料是由水合高分子材料交联形成的一种网络结构,它的化学性质与天然组织中包裹在细胞外的成分很相似。我们可以把功能性细胞包裹在这种材料中,并在贯穿凝胶的微管道中培养内皮细胞,从而构建拥有原始血管系统的组织样结构。
美国耶鲁大学的劳拉·尼克拉松(Laura Niklason)和兰格的研究表明,把培养着平滑肌细胞和内皮细胞的支架置入能提供脉动条件的生物反应器中,就能构建出较粗的血管。在这种条件下构建的动脉血管,可用于模拟血流在天然血管里的流动情况。将它移植到动物体内后,研究人员发现人造血管不仅具有较强的机械韧性,还能像天然血管一样发挥功能。尼克拉松和兰格制造的这种血管除了用于构建更大的组织结构,还可以直接用于心脏搭桥手术。
尽管在体外构建毛细血管样结构和较粗血管的研究取得了突破性进展,但要使植入体内的工程组织保持活力并行使功能,就必须在很短时间内,让植入组织与病人的血液系统相连。因此,诱导人体形成新的血管系统与构建工程组织同样重要。美国哈佛大学的戴维·穆尼(David Mooney)曾指出,利用高分子聚合微球或者支架材料,控制化学生长因子的释放,就可以促进新血管的生成,并让它们进入移植组织。
兰格和瓦坎蒂供职的美国Pervasis医疗公司正在进行一项临床试验,该公司研究人员对穆尼的方法作了一些改进。他们将含有平滑肌细胞和内皮细胞的三维支架移植到损伤部位附近,为血管修复提供生长信号,促进受损血管的重建(见中栏底图)。
尽管已取得了一些成果,但构建充满血管的大型组织和血管移植物时,科学家仍面临不少困难。新生血管的生长速度和向移植组织侵入的速度都很慢,导致移植组织中的很多细胞因缺乏血液供应而死亡。鉴于此,在构建大型组织和器官时,我们必须改进组织工程技术,预先在组织内部建造一个血管系统。此外,在建造血管系统的同时,还要结合控制血管生长因子释放的技术,以诱导工程组织内的血管进一步生长。
连接工程组织与病人的天然血管也很关键,因此研究人员需要进一步了解病人体内细胞与工程组织细胞间的相互作用,以便让移植组织能更好地与人体血管系统相连。要做到这一点,我们需要更多地破译细胞间以及细胞与周围环境间相互传递的信号,并积极扩展思路,从其他方面思考如何成功构建移植组织,比如选择更好的生物原材料。
突破“干细胞障碍”
大多数情况下,利用病人自身细胞构建可移植组织是最理想的选择,因为这样构建出的组织不会受到病人免疫系统的排斥。而且使用病人自身细胞构建移植材料,来自法规层面的阻碍也会少一些。但在培养过程中,普通体细胞的增殖能力有限,很难形成足以用于移植的组织。相对而言,来源于病人或捐赠者的成体干细胞(adult stem cell)的增殖能力更强,来源也比较广泛,可以从血液、骨骼、肌肉、血管、皮肤、头发毛囊、肠、大脑以及肝脏等很多组织或器官分离出来。
成体干细胞存在于成体组织中,它可以分化为组织内各种特性的细胞。但由于成体干细胞与正常细胞的形态差别不大,很难鉴别,科学家必须找到成体干细胞表面的分子标记——一些特异蛋白,才能把它们与普通细胞区别开来。找到的分子标记越多,鉴别成体干细胞就越容易,后续工作也越顺利。幸运的是,在过去几年里,科学家在这方面取得了很多重大进展,比如发明了多种分离成体干细胞的新方法,成功在体外诱导成体干细胞增殖,并让它们向不同的组织类型分化。
值得一提的是,美国宾夕法尼亚大学的克里斯多弗·陈(Christopher Chen)和丹尼斯·迪舍尔(Dennis Dishcher)指出,肌肉、骨骼或脂肪中的间充质干细胞(mesenchymal stem cell)会对来自周围环境的机械信号作出应答。他们的研究表明,间充质干细胞分化形成的组织的硬度,与它们分化生长时所依附的基质材料非常相近。其他科学家发现,培养基质或者周围环境发出的信号,对于引导成体干细胞分化形成何种组织非常重要。成体干细胞是否可以随意分化,形成与来源组织无关的另一种组织?科学家的意见并不统一,比如他们无法确定间充质干细胞能否分化成肝细胞。
与成体干细胞相比,胚胎干细胞(embryonic stem cell,ESC)更容易增殖,可以分化为所有类型的人体细胞。兰格与以色列理工学院(Technion-Israel Institute of Technology) 的舒拉米特·利文贝格(Shulamit Levenberg)及其同事共同研究发现,经过诱导,胚胎干细胞能在组织工程支架上分化成预期组织类型。这一结果表明,让胚胎干细胞在支架上直接分化为具有三维结构的组织是可行的。不过,胚胎干细胞也给科学家带来不少难题。
目前,让胚胎干细胞直接分化为同一类型的细胞仍十分困难。为了模拟胚胎干细胞在人体内的天然微环境,优化它们的分化过程,科学家正同时测试多种试验条件,以找到不同材料和化学物质发出信号的最佳组合。他们还对大量小分子和信号蛋白进行筛选,以找到控制干细胞特性的关键因子。
相关研究成果有助于培育具有胚胎干细胞特性、缺陷却更少的细胞。除了我们在前面提到的困难,科学家还不能预测把干细胞移植到病人体内后,它们会产生哪些效应。如果在移植前,胚胎干细胞没有完全分化为组织细胞,未分化的胚胎干细胞就可能形成肿瘤,引发癌症。为了绕开伦理上的限制,科学家也在探索一些新方法,培育非胚胎来源的胚胎干细胞样细胞,代替来源于人类胚胎的胚胎干细胞。
过去两年,在培育胚胎干细胞样细胞方面,科学家取得了重大进展,他们利用正常成体组织的细胞(如皮肤细胞)培育出了具有胚胎干细胞功能的细胞。对于组织工程学家来说,这些所谓的诱导多能干细胞(induced pluripotent stem cell,IPS cell)不仅能替代胚胎干细胞,还是一种“可再生资源”。2007年,日本京都大学的山中伸弥(Shiro Yamanaka)和美国威斯康星大学麦迪逊分校的詹姆斯·A·托马森(James A. Thomson)率先报道,通过激活控制干细胞特性的一些遗传信号通路,成体组织的细胞即可转化为诱导多能干细胞。
只要将4个关键调控基因转入成体皮肤细胞,就能使细胞重获胚胎干细胞的特性。早期试验中,山中伸弥和托马森以病毒为载体,将上述4个基因导入皮肤细胞。不过,如果把这种方式培育的细胞或组织用于病人,很可能让病人染上新的疾病。最近,更多的研究证明,非病毒方式也可将调控基因导入成体细胞,激活控制干细胞特性的基因,甚至仅转入一个调控基因都可以起到相同作用。这些研究进展让组织工程学家感到兴奋:也许用不了多久,来自病人自身、被赋予了干细胞特性的成体细胞,将成为构建工程组织的理想材料。
细胞的支架

10年前,科学家认为,细胞非常“聪明”,如果正确选择不同种类的细胞,把它们放在一起,细胞自己就清楚该干什么,自发形成天然组织。在一定程度上,这种方法是有效的。但现在,我们对于器官、组织在发育和行使正常功能时,细胞间以及细胞与环境间错综复杂的信号传导有了更深刻的认识。我们认为,在构建组织时,为细胞提供一个合适的环境非常重要。
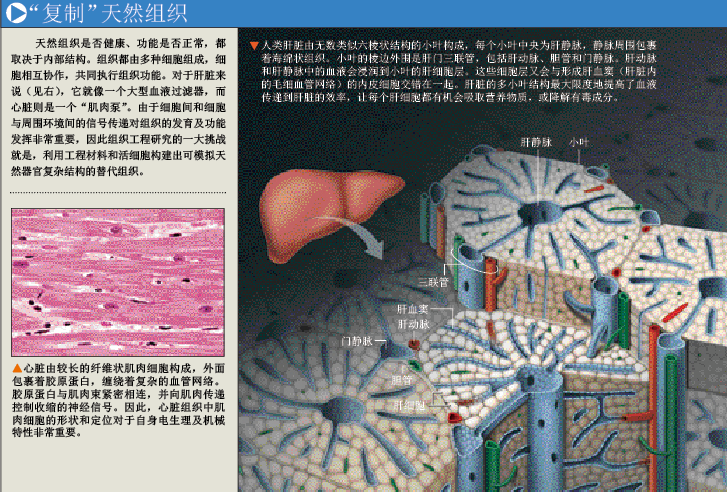
每个组织在体内都会行使特定功能,因此,替代组织也必须具有相应功能。我们开始了解到,尽可能完整地把天然组织的生物学机制“复制”到即将构建的组织上,是让工程组织发挥相应功能的关键一步。在更复杂的器官中,多种细胞必须相互协作,器官才能正常发挥功能。比如在肝脏中,既需要解毒的细胞,又需要参与营养代谢的细胞。因此,在构建组织时,组织内部的微结构、细胞间的相对位置必须重新调整,严格遵循天然组织的构成,才能让构建出的组织具有所需功能。
为了“仿制”天然组织的三维结构和组织中各细胞的空间组成,早期组织工程研究使用的支架都由多种材料制成。最近几年,一系列重要进展大幅提升了工程组织的复杂程度,这些组织的内部环境也更接近天然组织。比如,科学家可以将一个天然组织的所有细胞清除,只留下起连接作用的纤维网络,作为构建工程组织的支架。用这类支架构建的组织,可以重新获得原天然组织的很多功能。给人印象尤其深刻的一项研究是,研究人员去除啮齿类动物心脏上的细胞,得到一副纤维支架后,在上面培养心肌细胞和内皮细胞,让它们生成心肌纤维和血管结构,最终竟得到一个跳动着的心脏。
通过改良上述方法,组织工程学家还可以让细胞自己形成组织,或用支架材料做成一个框架,在上面培养细胞。模拟组织的天然结构同样可以引导细胞的排布。另一种从工程学借来的技术——电纺丝技术也可以用于制作支架,最终产品的质地近似于天然组织的支架:细细的高分子纤维在外界作用下被纺成网状支架,为细胞提供了一个更接近天然的三维环境,而且研究人员可以精细控制高分子纤维的化学和机械特性。美国塔夫斯大学的戴维·卡普兰(David Kaplan)就曾利用丝制品制作蜘蛛网状支架,用于构建韧带和骨头等组织。
由于生物、化学及机械特性很容易控制,凝胶不仅能很好地支撑和包裹细胞,还能提升工程组织的功能。对于包裹了活细胞的水凝胶,我们利用分类“打印”技术,或把它们分层排列,形成正确的组织结构。本文作者哈德姆侯赛尼的研究表明,由水凝胶包裹的细胞的聚合物可以被塑造成多种互补结构,把这些结构放在一起,它们就可以自我组装成更加复杂的结构。利用这一技术,科学家能够复制出组织中天然的细胞结构,比如肝脏就由许多六边形结构组成,每个六边形结构都含有毒素过滤细胞,细胞又包围着一根中央血管。
通过巧妙设计,有些水凝胶中的聚合物会在紫外线的照射下发生交联,使水凝胶形成预期结构。如果再将整个结构暴露于光线之下,就能得到进一步固化。美国科罗拉多大学博尔德分校的克里斯蒂·安塞斯(Kristi Anseth)和约翰斯·霍普金斯大学的詹尼弗·艾利塞弗(Jennifer Elisseeff),就利用交联水凝胶构建出了软骨和骨组织。研究人员还可以在凝胶里加入大量信号分子,促进组织的生长或分化。美国西北大学的萨穆埃尔·斯塔普(Samuel Stupp)研究证明,在水凝胶中加入特定小分子蛋白,作为引导细胞行为的环境信号,就能让包裹在凝胶中的神经干细胞分化为神经细胞。美国斯坦福大学的海伦·M·布劳(Helen M. Blau)也利用包裹了细胞外基质成分的水凝胶,来控制和研究单个干细胞的特性。
组织工程学家“武器清单”上的最后一项是纳米技术:它能用于制造适于移植的工程细胞薄片。日本东京女子医科大学的岡野光夫(Teruo Okano)制作了一种表面覆盖有热敏感高分子物质的材料,当温度从37℃降低到20℃时,这种材料会膨胀。岡野光夫先在这种纳米材料表面培养单层细胞,然后降低温度,使材料膨胀,形成一块一块的“细胞片”。这些“细胞片”可以叠加或卷起来,用于构建大型组织。
尽管在支架的排列和多样性研究中,科学家取得了一些进展,但该领域仍存在着许多难题。其中之一就是,在发育和伤口复原的特定阶段,各种组织中生长因子和细胞外分子的浓度和组成尚不清楚。如果弄清了这个问题,我们就可能模拟机体修复和发育的过程,更好地构建工程组织。因此,组织工程学家需要了解其他领域的一些研究情况,比如在机体发育和受损组织再生过程中,基因与蛋白间发生了哪些相互作用。结合这些发现,我们就可以利用更成熟的细胞培养系统,控制细胞在体外环境中的反应。不过,要做到这一点,还需要更多的突破才行。
组织工程时代
尽管工程化组织的构建仍然存在许多挑战,但已经不再是一个遥不可及的梦想。结构简单的人工组织已应用于临床医疗,为成千上万的人提供了可行的治疗方案。截至2008年底,组织工程产品的年销售额已经接近15亿美元。
10年前,我们为《科学美国人》撰写关于组织工程前景的文章后不久,组织工程研究就遭受不少挫折,但在这种情况下,科学家仍能取得如此成就实在难得。上世纪90年代末至本世纪初,世界各国曾在组织工程领域投入大量热情和资金,但随着网络经济泡沫的破裂,生物技术研究得到的资助开始减少。甚至一些通过美国食品及药品管理局(FDA)认证的公司也不得不调整自己的经营模式,推迟组织工程产品的上市时间。由于工程组织由细胞、具有生物活性的化学物质以及非生物支架材料构成,它们必须通过FDA的严格检验后才能上市——这个过程不仅需要大量资金支持,还得花费相当多的时间。资金缺乏也让公司难以开展广泛的临床试验。然而具有讽刺意味的是,组织工程产品商品化的延迟也有好处:这为相关技术的成熟以及商业途径的完善留下了更多时间。
组织工程还有发展空间。如何通过FDA认证仍是发展道路上的主要障碍。部分原因是来自不同的人的细胞在行为上可能存在差异,而且即便针对同一移植物,不同人的反应也不相同。正因为存在不可预见性,FDA很难确定一种组织工程产品是否安全有效。因此,科学家将来还得进行一项重要研究:检测个体差异,弄清楚为何会出现差异,再在组织工程产品的临床试验中,把这些因素都考虑进去。这项研究的花费,也将计入组织工程产品的研发成本中。
尽管如此,由于对组织发育和机体修复机制的不断了解,组织工程学家正致力于研发在机械特性、化学成分以及功能上更接近天然组织的第二代组织工程产品。即使在目前这种紧张经济形势下,我们仍认为,纳米技术、干细胞生物学、系统生物学和组织工程研究将很快交叉融合,催生新的研究思路,制造出更完善的替代器官,为更多的人消除病痛。
请 登录 发表评论