让婴儿一出生就携带生理缺陷的风疹(rubella)、让患儿必须依靠呼吸机才能存活的脊髓灰质炎(polio)、让孩子咳嗽到几乎喘不过气来的百日咳(whooping cough)……即使事隔多年,只要经历过这些疾病的人,想起发病时的情景仍会不寒而栗。幸运的是,由于可以接种疫苗,这些疾病已很少出现在现代人身上。
200多年来,在抗击传染病的努力中,疫苗接种是最有效、最经济、拯救生命数量最多的卫生措施之一,仅次于清洁供水。疫苗让全球亿万人民免受病痛折磨,拥有更长的寿命,并帮助人类于1979年在全球范围内消灭了天花。目前,科学家决心消灭脊髓灰质炎、麻疹,甚至疟疾——尽管我们知道,疟疾疫苗要成功发挥作用,需要找到新的免疫方式。
广义的疫苗接种是指,让人体接触少量已失去致病能力的微生物,“教会”免疫系统识别它们,这样一来,如果再次遇到这类微生物,免疫系统就能立即作出攻击反应。但经典疫苗并不适用于所有人群,也无法预防所有疾病。老年人等特殊人群免疫功能低下,传统疫苗根本诱导不出有效的免疫反应。有些致病微生物还能躲避疫苗诱导的免疫反应——疟疾、结核病、艾滋病等疾病,目前尚无法通过注射疫苗来预防。疫苗的预防范围也应扩大,把癌症、过敏症(allergy)、阿尔茨海默病(Alzheimer’s disease)等疾病也包括进来,这就要求免疫系统对一些通常难以识别,甚至根本无法识别的疾病相关分子作出反应。
在这种情况下,某些免疫刺激因子就显得非常重要,因为它们能提升免疫系统识别疫苗并对疫苗作出反应的能力。这类免疫刺激因子叫做“佐剂”(adjuvant),它的英文名起源于拉丁文中的adjuvare (意为“帮助”)。一些佐剂已有上百年的历史,常用于提升疫苗效力和强化癌症治疗效果。然而,对于佐剂与免疫细胞间的相互作用机制,科学家直到最近才弄清楚。过去十年,免疫学研究取得了很多重要进展,科学家对佐剂的作用机制有了更新更深刻的认识,为“疫苗个性化”铺平了道路:未来,科学家可以针对特定人群或病原体开发疫苗。利用新的研究手段,科学家已在研制一些曾被认为不可能开发出的疫苗,现有疫苗也将变得越来越有效。
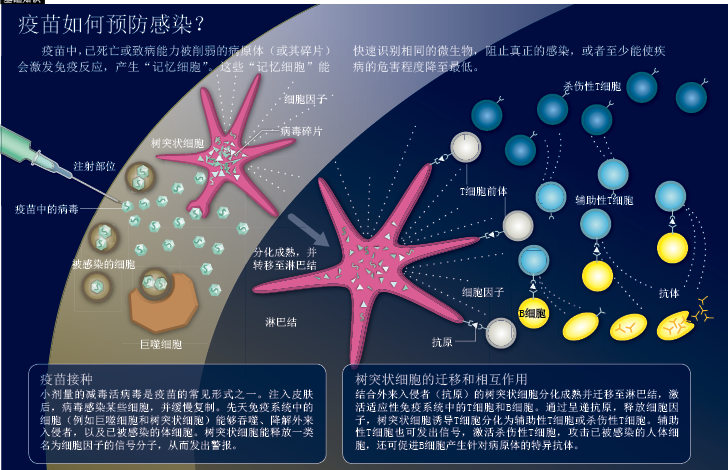
疫苗如何预防感染
很多自然感染都有一个好处:一次发病就能让人体对病原体产生终生免疫。一种理想的疫苗也应具有持久的保护能力,而且最好只需单次接种,不仅能针对一种病原体,还能防止与之相似的病原感染,比如能针对人类流感病毒家族中不断进化的所有成员。要达到这样的功效,疫苗必须在免疫系统中发挥多种细胞功能,就像病原体自然感染人体时引发的免疫反应一样。
当天然病原体首次入侵机体时,立即会遇到先天免疫系统中的细胞——后者一直处于巡逻状态,不断搜查外来入侵者。巨噬细胞(macrophages)和树突状细胞(dendritic cells)是先天免疫系统的重要成员,它们会吞噬和摧毁病原体,清除被感染的人体细胞。随后,这些防御细胞会分解吞噬掉的病原体,将病原体的组分,也就是抗原(antigen)展示在细胞表面,让适应性免疫系统(adaptive immune system)的T细胞和B细胞熟悉该病原体的外貌特征。与此同时,抗原呈递细胞(antigen-presenting cells)释放名为细胞因子(cytokines)的信号物质,引发炎症反应,通知T细胞和B细胞进入紧急状态。

熟悉了特异病原体的T细胞和B细胞一旦分化成熟,B细胞就会释放抗体分子,杀伤性T细胞则搜寻并摧毁已被病原体入侵的人体细胞。只需几天时间,抗原呈递细胞就能诱导出针对特定病原体的T细胞和B细胞。消灭病原体后,部分T细胞和B细胞会继续存活,作为“记忆细胞”(memory cells)在人体内呆上数十年之久,随时准备抵御同类病原体的再次感染。实际上,疫苗接种重现了自然感染过程,因为疫苗本身就是失去致病能力的病原体或病原体的某些组分,进入人体后,免疫系统会把它们看作外来入侵者。不过,并非所有疫苗都能成功诱导全面的免疫反应,某些病原体仅靠抗体就能扼制,不需要杀伤性T细胞的参与。
研制疫苗的过程中,科学家在选择抗原类型时,应考虑病原体的天然特性及其致病机制。制造一种标准疫苗所需的原料既可以是致病能力已被削弱的活细菌或病毒,也可以是已死亡、完全失去致病能力的完整病原微生物,或从病原体中分离出的蛋白质。每种选择都各有利弊。
减毒活疫苗(Live attenuated vaccines)能在人体内缓慢复制,因而可以不断产生抗原,刺激免疫系统,诱导强烈而持久的免疫反应。不过,也正因为减毒活疫苗能复制,接种后会有感染风险,因此这类疫苗不能用于免疫功能低下的个体,否则可能造成严重后果。某些活病毒疫苗还可能突变,恢复为致病病毒,因此对于艾滋病病毒(HIV)等致命性病原体,不能用它们制造减毒活疫苗。
由完整病毒颗粒制造的疫苗更为常见,不过其中的病毒已通过加热等方式“杀灭”。这些死亡病毒颗粒不能复制,但病毒蛋白仍然相对完整,容易为免疫细胞识别。不足之处在于,为了增强免疫反应,需要定期补充注射,强化免疫反应。
第三种为亚单位疫苗(subunit vaccine),仅是病原体的某些组分(抗原),而非完整的病原体。这些抗原可以从病原体中提取,也可以利用基因重组技术制造。由于亚单位疫苗仅包含病原体的一部分,有时无法刺激免疫系统发出危险信号,不能诱导最合适的免疫反应。
最近几年,科学家逐渐认识到抗原呈递细胞,尤其是树突状细胞,在评估病原体的威胁等级、决定需要作出哪些必要反应等方面发挥着重要作用。在感染病原体或注射疫苗的人体部位,树突状细胞吞噬抗原后就会分化成熟,迁移至邻近淋巴结(lymph nodes),释放信号分子诱导B细胞和T细胞作出反应。如果没有完整病原体特有的标志物,树突状细胞就无法分化成熟,也不能正确迁移至淋巴结。因此,亚单位疫苗通常需要添加佐剂,增强树突状细胞的活性。
目前,大多数疫苗都含有的佐剂是明矾(alum,铝盐类化学物质的简称)。自20世纪30年代以来,明矾一直是疫苗的“助手”,它的作用已得到很多现有疫苗的证实。然而,对于某些抗体防御不能有效预防的疾病,如果仍用明矾作为免疫佐剂,它能发挥的功效就很有限。
许多能引起致命性感染的病原体,如艾滋病病毒(HIV)、丙型肝炎病毒(hepatitis C virus)、结核分枝杆菌(Mycobacterium tuberculosis)和疟原虫(Plasmodium,疟疾的病原体),都能有效躲避抗体的攻击,因此针对这些病原体的有效疫苗必须要诱导出强烈的T细胞免疫反应。为抗击这些致命性病原体所作的努力,重新激发了科学家对免疫佐剂的兴趣,也让他们对免疫系统有了新的认识,这些认识又催生出更好的免疫佐剂。
佐剂的“复兴”
19世纪80年代,当法国科学家路易·巴斯德(Louis Pasteur)从一只患有狂犬病的牛头犬身上摘取唾液腺,制成第一支狂犬病疫苗时,一位美国医生其实在无意中发明了一种技术,可以全面增强病人的免疫反应。这项技术的发明,可以看作是佐剂在历史上的首次应用。当时的一些研究报告称,癌症患者感染一种特殊的链球菌(S. pyogenes)后,肿瘤会萎缩甚至完全消失,这立即引起了纽约癌症医院威廉·B·科利(William B. Coley)的兴趣。他推测,癌症患者对细菌的免疫反应,可能增强了他们对抗肿瘤细胞的能力。1881年,科利开展了一系列实验:先是给肿瘤患者接种活细菌,后来又为他们注射灭活的细菌。这些被称为“科利毒素”(Coley’s Toxins)的细菌的确能显著缓解癌症患者的病情,但这种方法的确切机制一直是一个谜。
20世纪初,科学家扩展了“科利毒素”的概念,开始测试各种能增强人体天然免疫反应的物质。在动物实验中,法国兽医学家加斯顿·拉蒙(Gaston Ramon)和英国免疫学家亚历山大·T·格伦尼(Alexander T. Glenny)检测了木薯淀粉(tapioca)、氢氧化铝等多种物质,看它们能否增强白喉(diphtheria)和破伤风(tetanus)疫苗的效力。20世纪30年代,一些科学家发现,悬浮在水-油乳化剂中的抗原能增强疫苗效力。同时,他们还在研究脂多糖(lipopolysaccharide,细菌细胞壁的一种组分)等细菌提取物是否也具有这样的功效。在这些“添加剂”中,不少都能增强免疫反应,但过度炎症反应等副反应也经常发生,导致此类方法的效果无法预测。
于是,科学家对佐剂的兴趣逐渐消退。直到20世纪80年代,一种新病毒的出现让科学家陷入前所未有的困境,他们才不得不试用任何能想到的防御策略。在与HIV的斗争中,传统疫苗毫无招架之力。这种病毒选择性地攻击T细胞,有效瓦解适应性免疫系统,而且还会持续突变,抗体根本跟不上它的变化。疫苗科学家必须找到能增强免疫系统识别HIV抗原能力的方法,这就要求他们综合应用已知佐剂,改进甚至创造新的佐剂。
佐剂研究的最大突破出现在1997年。科学家发现,存在于树突状细胞表面或者内部的特异性模式识别受体(pattern-recognition receptors)能识别微生物的基本组分,比如位于很多细菌尾部名为鞭毛素(flagellin)的蛋白。这些抗原识别受体能发出报警信号,激活树突状细胞,告诉细胞是哪种病原体入侵。在新发现的模式识别受体中,Toll 样受体(Toll-like receptor,TLR)对树突状细胞行为的影响似乎最为显著。
迄今为止,科学家已发现了10种功能性Toll样受体,每种受体都能识别病毒或细菌的一种基本组分,例如TLR-4能识别脂多糖(LPS),TLR-7则能识别某些病毒特有的单链RNA。这些发现清楚地告诉我们,细菌提取物之所以能用作免疫佐剂,是由于Toll样受体识别出它们后,向树突状细胞发出报警信号。佐剂作用机制的阐明意味着,疫苗研发者可采用一种或者联合几种佐剂来刺激Toll样受体。
提升疫苗效力
上世纪八九十年代,科学家开始鉴定和评估天然、合成及改良型佐剂,用于调节针对特定抗原或特定人群体内的免疫反应。这些佐剂既包括明矾等传统佐剂,也有水包油型乳化剂(oil-in-water emulsions),例如在欧洲用于某些流感疫苗的MF59和AS03。从更广泛的意义说,任何可作用于树突状细胞或其他免疫细胞、在量与质两个层面都能改善免疫反应的化学物质,都可以是免疫佐剂。
随着免疫学实验技术的进步,科学家现在已经能够去除早期佐剂中可能导致毒性反应的组分,还能通过混合和搭配不同的佐剂,最大限度地发挥佐剂的免疫刺激效应,诱导出理想的免疫反应。单磷酰脂质A(monophosphoryl lipid A,MPL)是一种新型佐剂,最初是脂多糖分子的组成部分。科学家将它从脂多糖分子上分离出来后,去除了毒性成分,并经过进一步纯化,得到了纯净的单磷酰脂质A。它既能像TLR-4一样刺激免疫系统,又不会引发毒性反应。目前,单磷酰脂质A已应用于数种疫苗,有些已经上市,有些则处于后期临床试验阶段,前景看好。
葛兰素史克生物制品公司疫苗佐剂中心(GlaxoSmithKline Biologicals’s vaccine adjuvant center)正在研制一种疟疾疫苗,其中就添加了单磷酰脂质A。本文作者加尔松是该中心的负责人,他参与了这种疟疾疫苗的研制。疟疾由疟原虫(Plasmodium)导致,是一种严重的感染性疾病,每年有上百万人因此死亡,其中绝大多数是5岁以下的儿童。疟原虫能隐藏在宿主细胞内,躲避免疫系统的攻击。在整个生命周期中,它们会多次改变形态,因此很难找到一种抗原,开发出能有效预防所有形态疟原虫感染的疫苗。重要的是,这种疫苗不仅需要诱导抗体反应,防止疟原虫进入细胞,还得诱导出T细胞介导的免疫反应,摧毁已感染疟原虫的细胞。要实现这个目标,我们需要比明矾更有效的新一代佐剂。
综合考虑各种因素,我们研发出一种以抗原RTS,S为基本组分的疟疾疫苗。这种抗原含有部分病原蛋白(通过基因重组技术制造),在疟原虫进入人类血细胞前或感染血细胞初期,这些蛋白存在于疟原虫表面。同时,RTS,S抗原还连接着乙型肝炎病毒(hepatitis B virus)的表面抗原,能进一步提升免疫系统的识别能力。接种时,与RTS,S抗原一起注入人体的还有一种佐剂混合物:包括一种水包油型乳剂、单磷酰脂质A和QS21(一种植物成分,20世纪30年代开始用于兽用疫苗)。优化了该疫苗的配方以后,我们和华特瑞陆军研究院(Walter Reed Army Institute of Research)的合作者进行了小范围的人体试验。自愿者将手臂伸入一个盒子,其中装有携带着疟原虫的蚊子,他们的手臂至少要被蚊子叮咬5次。结果,在7位接种疫苗的自愿者中,有6位都没有感染疟疾,然而在佐剂为明矾的对照组中,所有人都感染了疟疾。
在现实中(尤其是在非洲),人们长期面临疟原虫的威胁,可能被叮咬的次数远多于5次,因此在真实情况下展开试验,才能得到决定性结果。在冈比亚(Gambia),我们进行了更大规模的人体试验,时间长达9周,自愿者均为成年人。试验结果显示,71%的疫苗接种者都没有感染疟疾。不久后,我们又在莫桑比克(Mozambique)的疟疾流行区展开试验,对象为儿童。结果发现,注射了3次疫苗后,30%的儿童都能预防感染,而且在6个月内,接种过疫苗的儿童患严重疾病的几率降低了近60%。目前,该疫苗的一种改良版本(含有脂质体,liposome)在婴儿中进行的Ⅲ期临床试验已接近尾声。在预防疟疾感染和相关重大疾病方面,我们研制的这种疫苗是首个表现出明显效果的疫苗,承载着人们控制疟疾的希望。
这种疫苗的成功,显示出疫苗设计的潜力:合理搭配疫苗和佐剂,诱导出理想的免疫反应。不论开发新疫苗还是改进原有疫苗,这样的设计理念都很有用。很多现有疫苗虽说总体上是成功的,但对于特定人群,甚至是最需要注射这些疫苗的人,却显得并不安全和有效。季节性流感疫苗就是一个很好的例子:老年人和婴幼儿是最容易患致命性流感的人群,因为婴幼儿的免疫系统尚未发育成熟,而老年人的免疫反应强度会随年龄增长而下降。在接种了标准流感疫苗的65岁以上的老年人中,仅有一半能产生足够的抗体预防感染。
相反,一种含有水包油型乳化剂AS03的季节性流感疫苗能产生非常明显的预防效果:在65岁及以上的接种者中,90.5%的人都产生了保护性抗体。佐剂能增强免疫细胞对抗原的识别能力,因此添加佐剂后,只需较少的抗原就能生产出有效疫苗。这对于预防大范围流行疾病尤为重要,因为流行病暴发时,大量的人都须迅速接种疫苗。尚处于试验阶段的AS03疫苗是针对H5N1禽流感研制的,能引发有效的保护性抗体反应,所用抗原量仅相当于传统季节性流感疫苗的1/3。
以上实例表明,上世纪八九十年代对佐剂的研究和开发,现在到了开花结果的时候,各种新型疫苗将更广泛地应用于人类。在那段时期,科学家还认识到,树突状细胞对抗原的模式识别能力是联系先天性和适应性免疫系统的关键环节,这种认识直接推进了新型佐剂的研制。虽然这项工作尚处于早期阶段,但已具备产生一个“佐剂库”的潜力。以后,疫苗研发者就可以准确地从“佐剂库”中选取适合的佐剂,用于生产疫苗。
新一代佐剂
除了免疫学和分子生物学,材料学也为科学家提供很多改善佐剂功效的方法。脂质体载体(liposomal carriers)已用于制备包囊药物,它们能将包裹着的药物送到目标组织,避免药物在运送途中被机体降解。当用脂质体携带疫苗抗原时,它们也能够提供类似的保护作用:形成一个“仓库”,延长抗原刺激免疫细胞的时间。根据这个原理,科学家利用天然多糖(polysaccharide,细菌细胞壁成分)和合成聚酯(polyesters),构建出了“聚合物抗原笼”(polymer antigen cage)。在这些构建材料中,科学家还可以融入天然免疫刺激因子,或添加外源刺激因子,刺激免疫细胞发出预期信号。

由于免疫细胞间的交流机制已被破解,科学家逐渐意识到,在感染初期,树突状细胞发出的信号不仅具有报警作用,还能依据入侵病原体的类型引导免疫系统作出相应的反应。因此从理论上说,调整佐剂成分可诱导特定免疫反应——或偏重于抗体反应,或偏重于特定类群的T细胞反应。实际上,在科学家试验过的佐剂物质中,也包括信号分子本身。在肿瘤及艾滋病治疗中,医生长期用一种名为白细胞介素(interleukin,IL)的细胞因子(cytokine)增强患者的免疫反应。白细胞介素是树突状细胞自然分泌的,该细胞分泌的信号分子混合物能决定哪些免疫细胞作出反应,例如,IL-4、 IL-5和IL-6能促进杀伤性T细胞增殖,IL-2、IL-12则偏向于促进抗体反应。
组合不同的Toll样受体活化因子,也能得到类似的效果。多种Toll样受体都能识别微生物相关产物,TLR-4还能识别微生物在应激状态下释放的热休克蛋白(heat-shock proteins,参见《环球科学》2008年第8期《高温下的救命蛋白》)。Toll样受体活化因子配合油乳化剂(oil emulsion)等其他佐剂,能有效激活树突状细胞,在研制一些“高难度”疫苗,比如癌症疫苗时,这种方法可能非常有用。
对于科学家来说,研制癌症疫苗的确是难以达成的目标,因为癌细胞不是外来入侵者,而是病人身体自己产生的。因此,免疫系统虽然会对癌细胞作出一些反应,但通常不足以战胜癌症。科学家也曾尝试制备治疗性癌症疫苗,以诱导针对肿瘤细胞的免疫反应,但结果总是令人失望。不过,联合使用多种佐剂,就可能改变这种局面:在多项研究中,应用了不同佐剂组合的癌症疫苗已取得令人兴奋的结果。
目前正处于后期临床试验的一种癌症疫苗,就结合了癌细胞特异性抗原Mage-A3和一种佐剂混合物AS15(由稳定的脂质体、单磷酰脂质A、QS-21和一种细菌组分CpG构成)。在非小细胞肺癌(non-small cell lung cancer)患者中进行的临床试验显示,接种疫苗后,96%的患者都产生了强烈的、针对Mage-A3抗原的抗体反应,疫苗还触发了白细胞介素信号。结果,约1/3癌症患者的病情得到控制,有些患者的肿瘤甚至有消退的迹象。另一种处于试验中的癌症疗法结合了CpG、化疗和放疗,科学家希望用这种方法对抗数种癌症。CpG是一段独特的细菌DNA,能被TLR-9识别,激活树突状细胞,诱导强烈的T细胞免疫反应。因此,应用CpG其实就是重复当年威廉·B·科利用细菌治疗癌症的方法。把CpG作为佐剂开发的公司得名科利制药公司也算实至名归。
我们描述的各种佐剂系统将让疫苗预防更多疾病,解决更多的医学难题。在早期临床实验中,结合了CpG的豕草属(ragweed)植物抗原展现出成为枯草热(hayfever,又叫做花粉热)疫苗的潜力。由于佐剂能诱导免疫系统识别流感病毒,这让科学家能研制出针对多种流感病毒的疫苗。对于因疾病或化疗而导致免疫功能低下的病人,也可通过接种疫苗来激发免疫保护能力。佐剂虽然不可能克服现有疫苗的所有缺点,但它们肯定能提供部分解决方案。
当然,调节免疫功能是一项非常精细的工作,因此批判性地评估疫苗的安全性,公开下一代疫苗和佐剂的准确信息非常重要。深入理解新型疫苗中的佐剂在人体内的作用模式,将有利于引导疫苗开发,指导和监控疫苗的使用。令人兴奋的是,最先进的含有佐剂的预防性疫苗尚未显示出任何值得担忧的问题,不过疫苗研发者仍应保持高度警惕。
随着佐剂研究持续进步,疫苗将以合理的方式,安全有效地诱导最合理的免疫反应,更好地服务于特定人群。这就是疫苗发展的未来,这样的未来指日可待。
请 登录 发表评论