诺贝尔物理学奖得主理查德·费曼(Richard P.Feyman)留下了这样的名言:“如果发生了什么大的变故,以至于人类可能丧失所有的科学知识而只能留下一句话让未来的生物继承的话,那么,用最短的词语所能留下最多信息的话是什么呢?这句话就是:万物是由原子构成的(摘自《费曼物理学讲义1 力学》(理查德·费曼著))。”
你一定认为,“万物是由原子构成的”是理所当然的吧。确实,在现代,原子是能够被一个个地用图像化的方式表达出来的。在学校,关于“原子是存在的”的内容被安排在教科书的开头部分,让学生早早就能够学到。既然只能留下一句话,那么,留下与最前沿的科学有关的信息应该是最好的。
但是,原子的存在被大多数科学家所接受,实际上也仅仅是约100年前的事。此外,至此为止的道路并不是唯一的。至少,在两千多年中,围绕着“物质不断分解下去会变得怎么样”和“物质究竟是由什么构成的”之类的问题,科学家们互相争论、辩驳,在化学、力学、热力学等学科的各个舞台上,发挥想象力,提出设想、用实验证明、发现错误、提出新的设想……这样循环反复,一路走来。从这个过程中,人们获得了大量的知识。
让我们来重温一下关于原子的三个实验
虽然肉眼看不到,但原子确实存在,在它被大多数科学家认同的时代,还不能像现在这样用图像化的方式画出原子。那么,是如何让多数科学家们认同原子的存在是科学事实的呢?让我们看看长达2000年之久的论争中的三个实验和争议(关于科学家们是如何修改假设的,《谁看见了原子》(江泽洋著)一书中有详尽的介绍。)。
好,请大家从此忘记“原子是存在的”这个常识。让我们把自己当作二三百年前的科学家来参加讨论。例如,如下的第1个说明,能使你相信“原子是存在的”吗?
第1个说明 气体的化学反应
充满氧气和氢气的地方点燃电火花,就产生了水。加热这些水,就得到了水蒸气。在同温、同压的条件下,参与反应的氧气、氢气和生成的水蒸气,三者的体积存在着2:1:2的比例关系。能有这样固定的体积比,说明反应背后一定存在着某种规律。可以设想,无论哪一种气体,都是由无数的“分子”构成的,而所谓的分子,就是由“不能再分的粒子”——“原子”结合而成的。2个氢分子和1个氧分子进行反应,生成2个水分子。所以,最终的体积比就是2:1:2。
在这个说明中,把气体的化学反应解释为原子的重新组合。并且,在温度、压力等环境参数相同的情况下,分子的个数和体积的比是个常数,这个常数与物质的种类无关。这样,从“产生的气体和作为原材料的气体的体积比”这个宏观信息,就可以得知“生成一个水分子,需要原材料的氢分子和氧分子各多少个”的微观信息了。
让我们再看看对第1个说明的反驳
以上的说明,仿佛是一目了然的。但是,会不会有人感到上当受骗了呢?
在这个实验中,我们能够看到的只有“比例”。我们可以假设分子是存在的,被重新组合了,但也不是非这样假设不可。那么,像“分子是存在的,分子的个数和体积的比例是个常数”这样的假设,到底有没有根据呢?
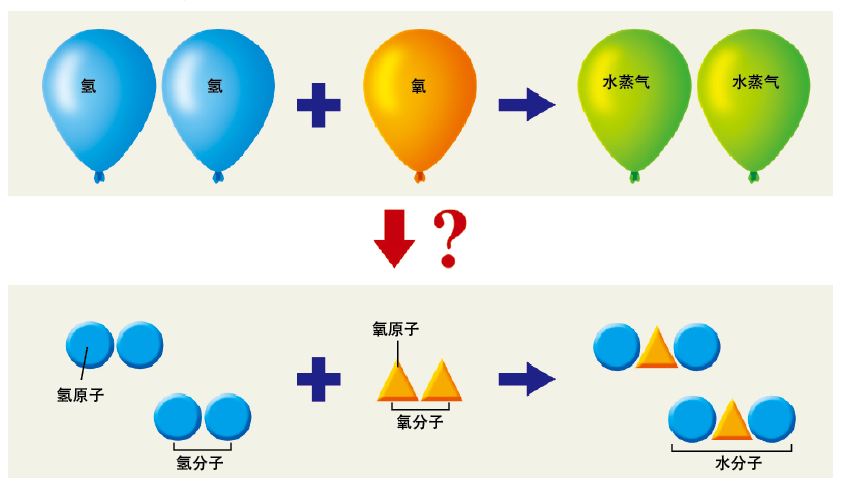
图 用“体积的比例关系”能说明原子是存在的吗?
如图中那样,我们可以设想氧原子和氢原子两两结合,变成水分子。那么,也可以设想4个氧原子和4个氢原子结合变成1个分子。我们还可以设想,每个水分子是由2个氧原子和4个氢原子结合而成的,最终得到的分子数比例也是一样的。
再者,1升的气体含有多少个分子,在这个实验中是未知的,而且是1万个还是1亿个都无关紧要,因为实验的结果并不取决于具体的分子数和重量。这样就可以认为,用分子来解释是一种“方便的说法”,并不是“分子存在的证明”。
有相信原子的科学家,同时也有不相信原子的科学家
在本例中,列举的是18世纪到19世纪前后,人们对发现了“气体反应法则”的法国的化学家盖-吕萨克发表的议论。那时,能够正确测量各种物质在化学反应前后的质量以及气体体积的方法已经普及,人们正热衷于研究化学反应前后的比例关系。例如,瑞典的化学家永斯·贝采利乌斯就发现,在多数反应中,原子质量的比是个常数。
随着各种各样的比例关系被发现,相信原子存在的科学家也随之增多。同时,对此表示慎重的科学家们认为,原子论只不过是一种“方便的说法”。他们认为,科学应该是限定在“能够用眼睛看见的、可以测定的手段进行验证的范围之内”的。
如果第1个说明是正确的,那么,某个固定体积的气体中所含的分子数将是固定的,和物质的种类无关。现在我们知道,在1个大气压、0℃时,22.4升的气体所含的原子数被称为“阿伏伽德罗常数(以意大利化学家阿莫迪欧·阿伏伽德罗的名字命名,他也是一名原子论者。现在,将阿伏伽德罗常数定义为12克同位素碳12所含的原子数)”。如果阿伏伽德罗常数是个常数,那么“2升氧气”中所含的氧分子数就是可知的,称出它的重量后,就能够求得单个氧分子的重量。但在当时,在很长的一段时间中,人们都没有研究出测定阿伏伽德罗常数的方法。
(本文发表于《科学世界》2015年第4期)
请 登录 发表评论